वर्तमान और वोल्टेज के लिए बिजली की गणना
जैसा कि आप जानते हैं, विद्युत वोल्टेज का अपना उपाय होना चाहिए, जो प्रारंभ में उस मूल्य से मेल खाता है जो ...
सी (कार्बोनेम), तत्वों की आवर्त सारणी के समूह IVA (सी, सी, जीई, एसएन, पीबी) का गैर-धातु रासायनिक तत्व। यह प्रकृति में हीरा क्रिस्टल (चित्र 1), ग्रेफाइट या फुलेरिन और अन्य रूपों के रूप में पाया जाता है और कार्बनिक (कोयला, तेल, पशु और पौधे जीव, आदि) और अकार्बनिक पदार्थ (चूना पत्थर, बेकिंग सोडा, आदि) का हिस्सा है। कार्बन व्यापक है, लेकिन पृथ्वी की परत में इसकी सामग्री केवल 0.1 9% है ( यह भी देखें डायमंड; फुलरीन)।
सरल पदार्थों के रूप में कार्बन का व्यापक रूप से उपयोग किया जाता है। कीमती हीरे के अलावा, जो गहने का विषय हैं, औद्योगिक हीरे बहुत महत्वपूर्ण हैं ?? पीसने और काटने के उपकरण के निर्माण के लिए। कार्कोल के चारकोल और अन्य असंगत रूपों का उपयोग प्रौद्योगिकी के क्षेत्रों में ब्लीचिंग, सफाई, गैस शोषण के लिए किया जाता है, जहां विकसित सतह वाले adsorbents की आवश्यकता होती है। कार्बाइड, धातुओं के साथ कार्बन यौगिकों के साथ-साथ बोरॉन और सिलिकॉन (उदाहरण के लिए, अल 4 सी 3, सीआईसी, बी 4 सी) के साथ उच्च कठोरता से विशेषता है और घर्षण और काटने के उपकरण के निर्माण के लिए उपयोग किया जाता है। कार्बन मूल राज्य में और कार्बाइड के रूप में स्टील और मिश्र धातु का हिस्सा है। उच्च तापमान (सीमेंटेशन) पर कार्बन के साथ स्टील कास्टिंग की सतह की संतृप्ति सतह की कठोरता को बढ़ाती है और प्रतिरोध पहनती है। यह भी देखें मिश्र धातु।
प्रकृति में, ग्रेफाइट के कई अलग-अलग रूप हैं; कुछ कृत्रिम रूप से प्राप्त कर रहे हैं; असंगत रूप हैं (उदाहरण के लिए, कोक और चारकोल)। सूट, हड्डी चारकोल, दीपक सूट, एसिटिलीन सूट ऑक्सीजन की कमी के साथ हाइड्रोकार्बन के दहन द्वारा गठित किया जाता है। तो कहा जाता है सफेद कार्बन कम दबाव के तहत पायरोलाइटिक ग्रेफाइट के उत्थान द्वारा प्राप्त किया जाता है ?? ये चित्रा किनारों के साथ ग्रेफाइट पत्तियों के सबसे छोटे पारदर्शी क्रिस्टल हैं।
Sunyaev Z.I. तेल कार्बन। एम।, 1 9 80
रसायन शास्त्र हाइपरकोर्डिनेटेड कार्बन। एम।, 1 99 0
"कार्बन" पर खोजें
4.1 कार्बन मोनोऑक्साइड।
4.2 कार्बनिक एसिड।
कार्बन जैविक, जैव कार्बनिक यौगिकों और कई बहुलक का आधार है।
अधिकांश कार्बन यौगिक कार्बनिक पदार्थ होते हैं, लेकिन इस काम में हम तथाकथित अकार्बनिक कार्बन यौगिकों पर ध्यान देंगे। इनमें शामिल हैं - साधारण पदार्थ (प्राकृतिक ग्रेफाइट, हीरा और सिंथेटिक रूप से व्युत्पन्न कार्बन), कार्बन ऑक्साइड, कार्बोनिक एसिड और कार्बनिक एसिड द्वारा गठित कई नमक।
कार्बन का सापेक्ष परमाणु द्रव्यमान 12.01 है, घनत्व (ग्रेफाइट का) 2.27 ग्राम / सेमी 3 है,
पिघलने बिंदु टीपीएल = 3370 डिग्री सेल्सियस (जलता है), उबलते बिंदु tbip = 4200 डिग्री सेल्सियस
2. कार्बन परमाणुओं की संरचना की विशेषताएं।
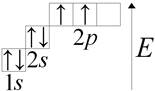
कार्बन यौगिकों की विविधता और बहुतायत को इसके परमाणु की संरचना द्वारा समझाया गया है। कार्बन परमाणु में अपने बाहरी चार परमाणु कक्षाओं में चार इलेक्ट्रॉन हैं। और सभी चार परमाणु कक्षाएं रासायनिक बंधनों के गठन में भाग लेती हैं।
विशेष रूप से, ग्रेफाइट और हीरा परमाणु क्रिस्टल लैटिस के साथ आवंटन परिवर्तन होते हैं जो उनकी संरचना में अलग होते हैं। इसलिए भौतिक और रासायनिक गुणों में मतभेद।
एक हीरे में, प्रत्येक कार्बन परमाणु चार अन्य परमाणुओं से बंधे होते हैं। अंतरिक्ष में, ये परमाणु केंद्र में स्थित होते हैं और उनके ऊर्ध्वाधर से जुड़े टेट्राहेड्रा के कोनों में स्थित होते हैं। यह एक बहुत ही सममित और टिकाऊ ग्रिल है।
डायमंड प्रकृति में सबसे कठिन पदार्थ माना जाता है।
ग्रेफाइट में, तीन परमाणु एक ही विमान में झूठ बोलते हुए जुड़े हुए होते हैं। इसलिए, इन बांडों का गठन तीन इलेक्ट्रॉनों के साथ तीन परमाणु कक्षाओं की भागीदारी के साथ होता है। प्रत्येक परमाणु एक ही विमान में झूठ बोलने वाले तीन अन्य लोगों से जुड़ा होता है। इन बॉन्ड के गठन पर तीन इलेक्ट्रॉनों के साथ तीन एओ खर्च किए जाते हैं। एक इलेक्ट्रॉन के साथ चौथा कक्षीय विमान के लिए लंबवत है। पूरे ग्रिड के ये शेष परमाणु कक्षाएं एक-दूसरे के साथ ओवरलैप होती हैं, आणविक कक्षाओं का एक क्षेत्र बनाते हैं। इस क्षेत्र में आधा हिस्सा है, जो अच्छी धातु चालकता के साथ हीरा के विपरीत, ग्रेफाइट प्रदान करता है।
3. भौतिक गुण।
यहां, सबसे पहले, ज़ाहिर है, हमें सरल कार्बन यौगिकों की उच्च शक्ति को ध्यान में रखना चाहिए।
हीरे और ग्रेफाइट समेत सरल और जटिल पदार्थों में कार्बन परमाणुओं के बीच बाध्यकारी ऊर्जा बहुत अधिक है। हीरा की कठोरता पहले से ही कहा जा चुका है। परमाणुओं और ग्रेफाइट ग्रिड में मजबूत बंधन।
उदाहरण के लिए, ग्रेफाइट फाइबर की तन्यता ताकत काफी हद तक लौह और तकनीकी स्टील की ताकत से अधिक है।
अपवर्तक, ग्रेफाइट की एक और अनूठी संपत्ति है, क्योंकि ग्रेफाइट का पिघलने बिंदु 3500 डिग्री सेल्सियस से ऊपर टीपीएल है प्रकृति में, ग्रेफाइट सबसे अपवर्तनीय सरल पदार्थ है।
ग्रेफाइट की उच्च विद्युत चालकता पर्यावरण के साथ किसी भी बातचीत उत्पादों की सतह पर अनुपस्थिति के कारण है, जैसे धातुओं पर ऑक्साइड।
इसके अलावा, ग्रेफाइट में सतहों को रगड़ने पर स्नेहन प्रभाव होने की क्षमता है। यह इस तथ्य से समझाया गया है कि ग्रेफाइट क्रिस्टल में कार्बन परमाणु एक दूसरे से सपाट मैसेज में दृढ़ता से जुड़े होते हैं, और मेष के बीच का बंधन कमजोर होता है और इसमें एक अंतःक्रियात्मक प्रकृति होती है (आणविक जाल वाले पदार्थों में)। नतीजतन, पहले से ही छोटी यांत्रिक ताकतों एक दूसरे के सापेक्ष ग्रिड के विस्थापन का कारण बनती हैं। यह एक स्नेहक के रूप में ग्रेफाइट की कार्रवाई का कारण बनता है।
4. कार्बन और इसके यौगिकों के रासायनिक गुण।
कार्बन के मुख्य रासायनिक गुणों में से एक इसकी मजबूत घटती गुण है। केवल अपेक्षाकृत कम तापमान पर, कार्बन रासायनिक रूप से निष्क्रिय है।
आइए कार्बन के रासायनिक गुणों पर नज़र डालें:
ऑक्सीजन सी + ओ 2 = सीओ 2 + क्यू में दहन;
कार्बन मोनोऑक्साइड के साथ बातचीत С + СО 2 = 2СО;
ऑक्साइड से धातुओं में कमी 3С + Fe 2 O 3 = 3CO 2 + 4Fe।
4.1 कार्बन मोनोऑक्साइड।
कार्बन मोनोऑक्साइड कार्बन और पदार्थों के पूर्ण दहन का उत्पाद है।
शर्तों के आधार पर ऑक्सीजन, कार्बन के साथ यौगिकों में, +2 और +4 के वैलेंस प्रदर्शित करता है।
कार्बन युक्त पदार्थों (फायरवुड, कोयला, प्राकृतिक गैस, मीथेन, शराब, आदि) के दहन के दौरान पारंपरिक लौ का तापमान, प्रतिक्रिया बढ़ जाती है:
सी + ओ 2 = सीओ 2
यदि, दूसरी तरफ, तापमान बढ़ाने के लिए स्थितियां बनाई जाती हैं, उदाहरण के लिए, गर्मी सिंक कम हो जाती है (ब्लास्ट फर्नेस सहित कोयले की एक मोटी परत के अंदर), तो प्रतिक्रियाएं आगे बढ़ती हैं:
सी + ओ 2 = 2CO
सीओ 2 + सी = 2CO
यह निम्नलिखित मामलों में भी बनाया गया है:
जैव रासायनिक प्रक्रियाओं का ऑक्सीकरण, श्वसन, क्षय,
मीथेन दहन
सीएच 4 + ओ 2 = सीओ 2 + 2 एच 2 ओ
कार्बोनेट के साथ एसिड की बातचीत
कार्बोनेट्स और बाइकार्बोनेट्स की थर्मल अपघटन:
CaCO 3 = CaO + CO 2
2 नाहाको 3 = ना 2 सीओ 3 + सीओ 2 + एच 2 ओ
कार्बन मोनोऑक्साइड हवा से भारी है, यह एक गंध रहित गैस, रंग और स्वाद है।
1. भंग होने पर, यह कार्बनिक एसिड बनाने के लिए पानी के साथ बातचीत करता है:
सीओ 2 + एच 2 ओ = एच 2 सीओ 3
2. प्रमुख ऑक्साइड के साथ प्रतिक्रिया:
सीओ 2 + CaO = CaCO 3
3. आधार के साथ प्रतिक्रिया:
सीओ 2 + सीए (ओएच) 2 = CaCO 3 + एच 2 ओ
4.2 कार्बनिक एसिड।
कमजोर डाइबासिक एसिड, जो तब बनता है जब कार्बन मोनोऑक्साइड सीओ 2 पानी में भंग हो जाता है।
कार्बनिक एसिड लवण की दो पंक्तियां देता है:
पानी घुलनशील बाइकार्बोनेट्स (नाहको 3 - बेकिंग सोडा, ना 2 सीओ 3 - सोडा, के 2 सीओ 3 - पोटाश),
अघुलनशील (एमजीसीओ 3, काको 3)।
हाइड्रोकार्बोनेट्स और कार्बोनेट्स के गठन की प्रतिक्रियाएं:
सीओ 2 + NaOH = NaHCO 3
सीओ 2 + 2 एनओओएच = ना 2 सीओ 3 + एच 2 ओ
कार्बनिक एसिड के नमक हाइड्रोलाइज्ड होते हैं।
मजबूत एसिड द्वारा लवण से कार्बोनिक एसिड विस्थापित किया जाता है:
काको 3 + 2 एचसीआई = सीएसीआई 2 + सीओ 2 + एच 2 ओ
5. कार्बन और इसके यौगिकों का उपयोग।
उद्योग में, कार्बन (ग्रेफाइट) अक्सर स्नेहक के रूप में प्रयोग किया जाता है।
इसके अलावा, ग्रेफाइट के आधार पर, तथाकथित समग्र सामग्रियों का उत्पादन विशेष रूप से कार्बन प्लास्टिक होता है, जिसमें ग्रेफाइट फाइबर इपीक्सी राल के मैट्रिक्स पर स्थित होते हैं।
शिप बिल्डिंग में ग्रेफाइट का जंग प्रतिरोध का उपयोग किया जाता है।
इन समग्र सामग्रियों का व्यापक रूप से विमानन और अंतरिक्ष प्रौद्योगिकी में उपयोग किया जाता है। आखिरकार, ताकत के अलावा, वे हल्के हैं। ग्रेफाइट, पी = 2.3 जी / सेमी 3 की घनत्व की तुलना करने के लिए पर्याप्त है, "प्रकाश" एल्यूमीनियम की घनत्व, पी = 2.7 जी / सेमी 3, और अधिक लौह, पी = 7.9 जी / सेमी 3, इस के मूल्य से आश्वस्त होने के लिए गुण।
और, ज़ाहिर है, हम सभी जानते हैं कि गहने उद्योग में सभी प्रकार के गहने के निर्माण के लिए हीरे का उपयोग किया जाता है, और विभिन्न उद्योगों में भी व्यापक रूप से उपयोग किया जाता है, जहां उनकी उच्च शक्ति संपत्ति का उपयोग किया जाता है।
एमओयू "निकिफोरोवस्काया माध्यमिक माध्यमिक विद्यालय №1"
कार्बन और इसके मुख्य अकार्बनिक यौगिकों
अमूर्त
पूर्ण: छात्र 9वी कक्षा
Sidorov अलेक्जेंडर
शिक्षक: सखारोवा एलएन।
Dmitrievka 200 9
परिचय
अध्याय I. कार्बन के बारे में सबकुछ
1.1। प्रकृति में कार्बन
1.2। ऑलोट्रॉपिक कार्बन संशोधन
1.3। कार्बन के रासायनिक गुण
1.4। कार्बन का उपयोग
अध्याय II अकार्बनिक कार्बन यौगिकों
निष्कर्ष
साहित्य
परिचय
कार्बन (लैट। कार्बनियम) सी आवधिक प्रणाली के समूह IV का एक रासायनिक तत्व है: परमाणु संख्या 6, परमाणु द्रव्यमान 12,011 (1)। कार्बन परमाणु की संरचना पर विचार करें। कार्बन परमाणु के बाहरी ऊर्जा स्तर पर चार इलेक्ट्रॉन हैं। ग्राफिक रूप से ड्रा करें:
कार्बन प्राचीन काल से ज्ञात है, और इस तत्व के खोजकर्ता का नाम अज्ञात है।
XVII शताब्दी के अंत में। फ्लोरेंटाइन के वैज्ञानिकों एवरानी और तर्डजोनी ने कई छोटे हीरे को एक बड़े में फ्यूज करने की कोशिश की और धूप से आग लगने वाले ग्लास की मदद से उन्हें गरम किया। हीरे गायब हो गए, हवा में जला दिया। 1772 में, फ्रांसीसी केमिस्ट ए Lavoisier दिखाया कि सीओ 2 हीरा के दहन के दौरान गठित किया गया है। केवल 17 9 7 में, अंग्रेजी वैज्ञानिक एस टेनेंट ने ग्रेफाइट और कोयले की प्रकृति की पहचान साबित कर दी। कोयले और हीरे की बराबर मात्रा के दहन के बाद, कार्बन मोनोऑक्साइड (चतुर्थ) की मात्रा समान हो गई।
कार्बन यौगिकों की विविधता, इसके परमाणुओं को एक-दूसरे के साथ गठबंधन करने और विभिन्न तरीकों से अन्य तत्वों के परमाणुओं की क्षमता के कारण, अन्य तत्वों के बीच कार्बन की विशेष स्थिति निर्धारित करती है।
सिर मैं । कार्बन के बारे में सब कुछ
1.1। प्रकृति में कार्बन
मुक्त राज्य और यौगिकों के रूप में दोनों कार्बन प्रकृति में पाए जाते हैं।
नि: शुल्क कार्बन हीरा, ग्रेफाइट और कार्बन के रूप में पाया जाता है।
हीरे बहुत दुर्लभ हैं। सबसे बड़ा ज्ञात हीरा, कुलिनन, दक्षिण अफ्रीका में 1 9 05 में पाया गया था, 621.2 ग्राम वजन था, और 10 × 6.5 × 5 सेमी मापा गया। मॉस्को में डायमंड फंड में सबसे बड़ा और सबसे खूबसूरत हीरा संग्रहीत किया जाता है। दुनिया - "ईगल" (37.9 2 ग्राम)।
हीरा को ग्रीक से अपना नाम मिला। "एडमस" - अजेय, अविनाशी। सबसे महत्वपूर्ण हीरा जमा दक्षिण अफ्रीका, ब्राजील और याकुतिया में स्थित हैं।
ग्रेफाइट की बड़ी जमा जर्मनी में, श्रीलंका में, साइबेरिया में, अल्ताई में स्थित है।
मुख्य कार्बन युक्त खनिजों हैं: मैग्नेसाइट एमजीसीओ 3, कैल्साइट (नींबू स्पार, चूना पत्थर, संगमरमर, चाक) CaCO 3, डोलोमाइट CaMg (सीओ 3) 2, आदि
सभी दहनशील खनिज - तेल, गैस, पीट, पत्थर और भूरा कोयला, शैल - कार्बन आधार पर बनाए जाते हैं। 99% सी तक युक्त कुछ जीवाश्म कोयला कार्बन की संरचना में करीब है।
पृथ्वी की परत का 0.1% कार्बन का खाता है।
कार्बन मोनोऑक्साइड (चतुर्थ) सीओ 2 कार्बन के रूप में वातावरण का एक घटक है। हाइड्रोस्फीयर में सीओ 2 की बड़ी मात्रा भंग हो जाती है।
1.2। ऑलोट्रॉपिक कार्बन संशोधन
मौलिक कार्बन तीन आलोट्रोपिक संशोधनों का निर्माण करता है: हीरा, ग्रेफाइट, कार्बिन।
1. डायमंड - एक रंगहीन, पारदर्शी क्रिस्टलीय पदार्थ, प्रकाश की किरणों को बेहद दृढ़ता से अपवर्तित करता है। हीरे में कार्बन परमाणु एसपी 3 संकरण की स्थिति में हैं। उत्तेजित राज्य में, कार्बन परमाणुओं में वैलेंस इलेक्ट्रॉनों का वाष्पीकरण होता है और चार unpaired इलेक्ट्रॉनों का गठन होता है। जब रासायनिक बंधन बनते हैं, तो इलेक्ट्रॉन बादल एक ही विस्तारित आकार प्राप्त करते हैं और अंतरिक्ष में व्यवस्थित होते हैं ताकि उनकी अक्ष को टेट्राहेड्रोन के शिखर पर निर्देशित किया जा सके। जब इन बादलों के शीर्ष अन्य कार्बन परमाणुओं के बादलों के साथ ओवरलैप होते हैं, तो सहसंयोजक बंधन 109 डिग्री 28 के कोण पर उभरते हैं ", और हीरे की एक परमाणु क्रिस्टल जाली विशेषता बनती है।
एक हीरे में प्रत्येक कार्बन परमाणु चार अन्य लोगों से घिरा हुआ है, जो टेट्राहेड्रा के केंद्र से शीर्ष तक दिशाओं में स्थित है। टेट्राहेड्रा में परमाणुओं के बीच की दूरी 0.154 एनएम है। सभी बंधनों की ताकत एक जैसी है। इस प्रकार, एक हीरे में परमाणु बहुत कसकर "पैक" होते हैं। 20 डिग्री सेल्सियस पर, हीरा की घनत्व 3.515 ग्राम / सेमी 3 है। यह इसकी असाधारण कठोरता बताता है। डायमंड विद्युत प्रवाह खराब खराब करता है।
1 9 61 में, सोवियत संघ ने ग्रेफाइट से सिंथेटिक हीरे का औद्योगिक उत्पादन शुरू किया।
हीरे के औद्योगिक संश्लेषण में 1500 से 3000 डिग्री सेल्सियस के हजारों एमपीए और तापमान में दबाव का उपयोग किया जाता है। प्रक्रिया उत्प्रेरक की उपस्थिति में आयोजित की जाती है, जो कुछ धातुओं की सेवा कर सकती है, उदाहरण के लिए नी। गठित हीरे के बड़े हिस्से छोटे क्रिस्टल और हीरे की धूल होते हैं।
1000 डिग्री सेल्सियस से ऊपर हवा के बिना गर्म होने पर, हीरा ग्रेफाइट में बदल जाता है। 1750 डिग्री सेल्सियस पर, हीरा से ग्रेफाइट का रूपांतरण जल्दी होता है।
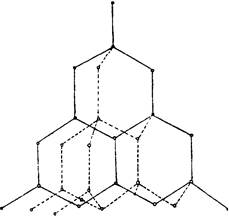
डायमंड संरचना
2. ग्रेफाइट एक धातु के चमक के साथ एक भूरा-काला क्रिस्टलीय पदार्थ है, स्पर्श करने के लिए तेल, पेपर तक कठोरता में कम है।
ग्रेफाइट क्रिस्टल में कार्बन परमाणु एसपी 2 संकरण की स्थिति में हैं: उनमें से प्रत्येक पड़ोसी परमाणुओं के साथ तीन सहसंयोजक σ बंधन बनाता है। बंधन दिशाओं के बीच कोण 120 डिग्री हैं। नतीजा नियमित हेक्सागोन से बना ग्रिड है। परत के अंदर कार्बन परमाणुओं के आसन्न नाभिक के बीच की दूरी 0.142 एनएम है। ग्रेफाइट में प्रत्येक कार्बन परमाणु की बाहरी परत का चौथा इलेक्ट्रॉन एक पी-कक्षीय द्वारा कब्जा कर लिया जाता है जो संकरण में भाग नहीं लेता है।
कार्बन परमाणुओं के गैर-संकर इलेक्ट्रॉन बादल परत के विमान के लिए लंबवत उन्मुख होते हैं, और एक-दूसरे के साथ ओवरलैपिंग करते हैं, जो डीसीओलाइज्ड σ-bonds बनाते हैं। ग्रेफाइट क्रिस्टल में पड़ोसी परतें 0.335 एनएम अलग हैं और कमजोर रूप से एक दूसरे से जुड़े हुए हैं, मुख्य रूप से वैन डेर वाल्स बलों द्वारा। इसलिए, ग्रेफाइट में कम यांत्रिक शक्ति होती है और आसानी से तराजू में विभाजित होती है, जो स्वयं बहुत टिकाऊ होते हैं। ग्रेफाइट में कार्बन परतों के बीच का बंधन आंशिक रूप से धातु है। यह इस तथ्य को बताता है कि ग्रेफाइट बिजली को अच्छी तरह से संचालित करता है, लेकिन धातुओं के जितना अच्छा नहीं है।

ग्रेफाइट संरचना
ग्रेफाइट में भौतिक गुण दिशाओं में काफी भिन्न होते हैं - कार्बन परमाणुओं की परतों के लंबवत और समानांतर।
हवा के बिना गर्म होने पर, ग्रेफाइट 3700 डिग्री सेल्सियस तक के किसी भी बदलाव से गुजरता नहीं है। इस तापमान पर, यह पिघला नहीं, उगता है।
कृत्रिम ग्रेफाइट को बिजली के भट्टियों में 3000 डिग्री सेल्सियस पर कोयले के सर्वोत्तम ग्रेड से हवा के उपयोग के बिना प्राप्त किया जाता है।
ग्रेफाइट तापमान और दबाव की एक विस्तृत श्रृंखला पर थर्मोडायनामिक रूप से स्थिर है, इसलिए, इसे कार्बन की मानक स्थिति के रूप में स्वीकार किया जाता है। ग्रेफाइट का घनत्व 2.265 ग्राम / सेमी 3 है।
3. कार्बन - बढ़िया काला पाउडर। इसकी क्रिस्टल संरचना में, कार्बन परमाणु रैखिक श्रृंखलाओं में सिंगल और ट्रिपल बॉन्ड को वैकल्पिक रूप से जोड़कर जुड़े होते हैं:
-С≡С - С≡С - С≡С-
इस पदार्थ को पहले वी.वी. द्वारा प्राप्त किया गया था। Korshakom, एएम। स्लैडकोव, वी.आई. Kasatochkin, यू.पी. XX शताब्दी के शुरुआती 60 के दशक में Kudryavtsevym।
इसके बाद, यह दिखाया गया था कि कार्बन विभिन्न रूपों में मौजूद हो सकता है और इसमें पॉलीएसिटाइलीन और पॉलीक्यूमिलीन श्रृंखलाएं होती हैं जिनमें कार्बन परमाणु डबल बॉन्ड से जुड़े होते हैं:
सी = सी = सी = सी = सी = सी =
बाद में कार्बिन प्रकृति में पाया गया - एक उल्कापिंड पदार्थ में।
कार्बिन में प्रकाश की क्रिया के तहत अर्धचालक गुण होते हैं, इसकी चालकता बहुत बढ़ जाती है। विभिन्न प्रकार के बॉन्ड के अस्तित्व और क्रिस्टल जाल में कार्बन परमाणुओं की श्रृंखला को बिछाने के विभिन्न तरीकों के कारण, कार्बन के भौतिक गुण व्यापक रूप से भिन्न हो सकते हैं। 2000 डिग्री सेल्सियस से ऊपर हवा के बिना गर्म होने पर, कार्बन स्थिर है; लगभग 2300 डिग्री सेल्सियस के तापमान पर, ग्रेफाइट में इसका संक्रमण मनाया जाता है।
प्राकृतिक कार्बन में दो आइसोटोप होते हैं
(98.8 9 2%) और (1.108%)। इसके अलावा, कृत्रिम माध्यमों द्वारा प्राप्त एक रेडियोधर्मी आइसोटोप की महत्वहीन अशुद्धता, वातावरण में पाई जाती है।पहले यह माना जाता था कि चारकोल, सूट और कोक शुद्ध कार्बन की संरचना में समान होते हैं और हीरे और ग्रेफाइट से गुणों में भिन्न होते हैं, कार्बन ("असंगत कार्बन") के एक स्वतंत्र आवंटन संशोधन का प्रतिनिधित्व करते हैं। हालांकि, यह पाया गया कि इन पदार्थों में सबसे छोटे क्रिस्टलीय कण होते हैं जिनमें कार्बन परमाणु ग्रेफाइट के समान ही होते हैं।
4. कोयला - बारीक जमीन ग्रेफाइट। यह हवा की पहुंच के बिना कार्बन युक्त यौगिकों के थर्मल अपघटन के दौरान गठित होता है। कोयले उन पदार्थों के आधार पर गुणों में महत्वपूर्ण रूप से भिन्न होते हैं, जिनसे उन्हें प्राप्त किया जाता है और उत्पादन की विधि होती है। वे हमेशा अशुद्धताएं रखते हैं जो उनके गुणों को प्रभावित करते हैं। कोयला, चारकोल, और सूट कोयला के सबसे महत्वपूर्ण प्रकार हैं।
बिना कोले के कोयले को गर्म करके कोक प्राप्त किया जाता है।
चारकोल का गठन होता है जब लकड़ी को हवा के बिना गरम किया जाता है।
सूट एक बहुत बढ़िया ग्रेफाइट क्रिस्टलीय पाउडर है। हवा की सीमित पहुंच के साथ हाइड्रोकार्बन (प्राकृतिक गैस, एसिटिलीन, टर्पेन्टाइन, आदि) के दहन द्वारा निर्मित।
सक्रिय कार्बन मुख्य रूप से कार्बन से युक्त छिद्रपूर्ण औद्योगिक adsorbents हैं। Adsorption गैसों और solutes के ठोस की सतह से अवशोषण को संदर्भित करता है। सक्रिय कार्बन ठोस ईंधन (पीट, भूरा और काला कोयला, एंथ्रासाइट), लकड़ी और उसके उत्पादों (चारकोल, भूसा, पेपर अपशिष्ट), चमड़े के उद्योग के अपशिष्ट, हड्डियों जैसे पशु मूल की सामग्री से प्राप्त होते हैं। उच्च यांत्रिक स्थायित्व में भिन्न कोयले, फल के पत्थरों से नारियल के एक खोल और अन्य पागल से बनाते हैं। कोयले की संरचना सभी आकारों के छिद्रों द्वारा दर्शायी जाती है, हालांकि, सोखना क्षमता और सोखना की दर प्रति यूनिट द्रव्यमान या ग्रेन्युल की मात्रा के माइक्रोप्रोर्स की सामग्री द्वारा निर्धारित की जाती है। सक्रिय कोयले के उत्पादन में, प्रारंभिक सामग्री को पहले बिना हवा के गर्मी उपचार के अधीन किया जाता है, जिसके परिणामस्वरूप नमी और राल का हिस्सा हटा दिया जाता है। यह कोयला की एक बड़ी छिद्र संरचना बनाता है। एक सूक्ष्म संरचना प्राप्त करने के लिए, सक्रियण गैस या भाप ऑक्सीकरण या रासायनिक अभिकर्मकों के साथ इलाज द्वारा किया जाता है।
1.3। कार्बन के रासायनिक गुण
सामान्य तापमान, हीरा, ग्रेफाइट और कोयले रासायनिक रूप से निष्क्रिय होते हैं, लेकिन उच्च तापमान पर उनकी गतिविधि बढ़ जाती है। कार्बन के मुख्य रूपों की संरचना के अनुसार, कोयले ग्रेफाइट और विशेष रूप से हीरे की तुलना में अधिक आसानी से प्रतिक्रिया करता है। ग्रेफाइट केवल हीरे की तुलना में अधिक प्रतिक्रियाशील नहीं है, लेकिन, कुछ पदार्थों के साथ प्रतिक्रिया करके, यह उन उत्पादों को बना सकता है जो हीरे नहीं बनते हैं।
1. एक ऑक्सीकरण एजेंट के रूप में, कार्बन उच्च तापमान पर कुछ धातुओं के साथ प्रतिक्रिया करता है, कार्बाइड बना रहा है:
सीएस + 4 एएल = अल 4 सी 3 (एल्यूमिनियम कार्बाइड)।
2. हाइड्रोजन, कोयले और ग्रेफाइट फॉर्म हाइड्रोकार्बन के साथ। सबसे सरल प्रतिनिधि - मीथेन सीएच 4 - उच्च तापमान (600-1000 डिग्री सेल्सियस) पर नी उत्प्रेरक की उपस्थिति में प्राप्त किया जा सकता है:
सीएच 4।3. ऑक्सीजन के साथ बातचीत करते समय कार्बन गुणों को कम करता है। किसी भी एलोट्रॉपिक संशोधन के कार्बन के पूर्ण दहन के साथ, कार्बन मोनोऑक्साइड (IV) का गठन होता है:
सी + ओ 2 = सीओ 2।
अपूर्ण दहन कार्बन मोनोऑक्साइड (II) सीओ का उत्पादन करता है:
सी + ओ 2 = 2 एसओ।
दोनों प्रतिक्रियाएं exothermic हैं।
4. धातु ऑक्साइड (जस्ता, तांबा, सीसा, आदि) के साथ बातचीत करते समय विशेष रूप से उज्ज्वल गुणों को कोयले के गुणों को प्रकट किया जाता है, उदाहरण के लिए:
सी + 2 क्यूओ = सीओ 2 + 2 क्यू,
С + 2ZnO = СО 2 + 2Zn।
इन प्रतिक्रियाओं पर धातु विज्ञान की सबसे महत्वपूर्ण प्रक्रिया आधारित है - अयस्कों से धातुओं की गंध।
अन्य मामलों में, उदाहरण के लिए, कैल्शियम ऑक्साइड के साथ बातचीत करते समय, कार्बाइड बनते हैं:
CaO + ZS = CaC 2 + CO।
5. कोयला गर्म केंद्रित सल्फ्यूरिक और नाइट्रिक एसिड द्वारा ऑक्सीकरण किया जाता है:
सी + 2 एच 2 एसओ 4 = सीओ 2 + 2 एसओ 2 + 2 एच 2 ओ,
ЗС + 4НNО 3 = ЗСО 2 + 4NO + 2Н 2 ओ।
क्षार के प्रतिरोधी कार्बन का कोई भी रूप!
1.4। कार्बन का उपयोग
चट्टानों को ड्रिल करने के लिए, काटने, पीसने, ड्रिलिंग और उत्कीर्णन के लिए विभिन्न ठोस सामग्रियों को संसाधित करने के लिए हीरे का उपयोग किया जाता है। पीसने और काटने के बाद, हीरे गहने के रूप में इस्तेमाल हीरे में बदल जाते हैं।
ग्रेफाइट आधुनिक उद्योग के लिए सबसे मूल्यवान सामग्री है। कास्टिंग मोल्ड, पिघलने वाले क्रूसिबल और अन्य अपवर्तक उत्पाद ग्रेफाइट से बने होते हैं। इसकी उच्च रासायनिक स्थिरता के कारण, ग्रेफाइट का उपयोग अंदर से ग्रेफाइट प्लेटों के साथ पाइप और उपकरण के निर्माण के लिए किया जाता है। इलेक्ट्रिकल उद्योग में ग्रेफाइट की महत्वपूर्ण मात्रा का उपयोग किया जाता है, उदाहरण के लिए, इलेक्ट्रोड के निर्माण में। एक स्नेहक के रूप में, पेंसिल और कुछ पेंट्स के निर्माण के लिए ग्रेफाइट का उपयोग किया जाता है। न्यूट्रॉन को धीमा करने के लिए परमाणु रिएक्टरों में बहुत शुद्ध ग्रेफाइट का उपयोग किया जाता है।
रैखिक कार्बन बहुलक - कार्बन - अर्धचालक के निर्माण के लिए वैज्ञानिकों का ध्यान एक आशाजनक सामग्री के रूप में आकर्षित करता है, जो उच्च तापमान, और अल्ट्रा-मजबूत फाइबर पर काम कर सकता है।
चारकोल का उपयोग मेटलर्जिकल उद्योग में, ब्लैकस्मिथिंग में किया जाता है।
अयस्क से धातुओं की गंध में कोक को कम करने वाले एजेंट के रूप में प्रयोग किया जाता है।
ताकत बढ़ाने के लिए सूट को रबड़ भराव के रूप में प्रयोग किया जाता है, इसलिए कार टायर काले होते हैं। सूट का उपयोग प्रिंट स्याही, मस्करा, जूता पॉलिश के घटक के रूप में भी किया जाता है।
विभिन्न कार्बनों को साफ करने, निकालने और अलग करने के लिए सक्रिय कार्बन का उपयोग किया जाता है। सक्रिय कार्बन गैस मास्क के लिए fillers के रूप में और दवा में एक sorbent के रूप में उपयोग किया जाता है।
सिर द्वितीय । अकार्बनिक कार्बन यौगिकों
कार्बन दो ऑक्साइड बनाता है - कार्बन मोनोऑक्साइड (II) सीओ और कार्बन मोनोऑक्साइड (चतुर्थ) सीओ 2।
कार्बन मोनोऑक्साइड (II) सीओ एक रंगहीन, गंध रहित गैस है, जो पानी में खराब घुलनशील है। इसे कार्बन मोनोऑक्साइड कहा जाता है, क्योंकि यह बहुत जहरीला है। रक्त में सांस लेने पर, यह जल्दी ही हीमोग्लोबिन के साथ मिलकर बनता है, जो एक मजबूत यौगिक कार्बोक्सीमोग्लोबिन बनाता है, जिससे ऑक्सीजन ले जाने की क्षमता के हीमोग्लोबिन को वंचित कर दिया जाता है।
0.1% सीओ युक्त हवा में सांस लेने पर, एक व्यक्ति अचानक चेतना खो सकता है और मर सकता है। कार्बन मोनोऑक्साइड ईंधन के अपूर्ण दहन के दौरान गठित होता है, यही कारण है कि समय-समय पर चिमनी बंद करना इतना खतरनाक है।
कार्बन मोनोऑक्साइड (II) को जिम्मेदार ठहराया जाता है, जैसा कि आप पहले ही जानते हैं, गैर-नमक बनाने वाले ऑक्साइड के लिए, चूंकि गैर-धातु ऑक्साइड के रूप में, इसे नमक और पानी बनाने के लिए क्षार और मूल आक्साइड के साथ प्रतिक्रिया करनी चाहिए, लेकिन यह नहीं देखा जाता है।
2CO + ओ 2 = 2CO 2।
कार्बन मोनोऑक्साइड (द्वितीय) धातु ऑक्साइड से ऑक्सीजन लेने में सक्षम है, यानी। धातुओं को अपने ऑक्साइड से ठीक करने के लिए।
Fe 2 O 3 + SOA = 2Fe + SOA 2।
लोहे की गंध में धातु विज्ञान में इस्तेमाल कार्बन मोनोऑक्साइड (II) की यह संपत्ति है।
कार्बन मोनोऑक्साइड (चतुर्थ) सीओ 2 - आमतौर पर कार्बन डाइऑक्साइड के रूप में जाना जाता है - एक रंगहीन, गंध रहित गैस है। यह हवा की तुलना में डेढ़ गुना भारी है। सामान्य परिस्थितियों में, कार्बन डाइऑक्साइड की 1 मात्रा पानी की 1 मात्रा में घुल जाती है।
लगभग 60 एटीएम के दबाव के साथ, कार्बन डाइऑक्साइड एक रंगहीन तरल में बदल जाता है। जब तरल कार्बन डाइऑक्साइड वाष्पित हो जाता है, इसका एक हिस्सा एक ठोस बर्फ की तरह द्रव्यमान में बदल जाता है, जिसे उद्योग में दबाया जाता है - यह आपको "शुष्क बर्फ" है, जिसे भोजन को स्टोर करने के लिए उपयोग किया जाता है। आप पहले से ही जानते हैं कि ठोस कार्बन डाइऑक्साइड में आणविक जाली है, जो उत्थान के लिए सक्षम है।
कार्बन डाइऑक्साइड सीओ 2 एक ठेठ एसिड ऑक्साइड है: यह मूल ऑक्साइड और पानी के साथ, क्षार के साथ प्रतिक्रिया करता है (उदाहरण के लिए, यह टर्बिड चूने के पानी का कारण बनता है)।
यह जला नहीं जाता है और दहन को बनाए रखता नहीं है, और इसलिए आग बुझाने के लिए प्रयोग किया जाता है। हालांकि, मैग्नीशियम ऑक्साइड बनाने और सूट के रूप में कार्बन को मुक्त करने के लिए कार्बन डाइऑक्साइड में जल रहा है।
सीओ 2 + 2 एमजी = 2 एमजीओ + सी
कार्बन डाइऑक्साइड कार्बनिक एसिड के नमक पर काम करके प्राप्त किया जाता है - हाइड्रोक्लोरिक, नाइट्रिक, और यहां तक कि एसिटिक एसिड के समाधान के साथ कार्बोनेट। प्रयोगशाला में, कार्बन डाइऑक्साइड चाक या संगमरमर पर हाइड्रोक्लोरिक एसिड की क्रिया द्वारा उत्पादित किया जाता है।
CaCO 3 + 2HCl = CaCl 2 + H 2 0 + C0 2।
उद्योग में, चूना पत्थर जलाने से कार्बन डाइऑक्साइड प्राप्त होता है:
CaCO 3 = CaO + C 2।
पहले से उल्लिखित आवेदन के अलावा कार्बन डाइऑक्साइड का उपयोग effervescent पेय पदार्थों के उत्पादन और सोडा के उत्पादन के लिए भी किया जाता है।
जब कार्बन (चतुर्थ) ऑक्साइड पानी में भंग हो जाता है, कार्बनिक एसिड एच 2 सीओ 3 का गठन होता है, जो बहुत अस्थिर होता है और आसानी से इसके शुरुआती घटकों - कार्बन डाइऑक्साइड और पानी में विघटित होता है।
एक डिबासिक एसिड के रूप में, कार्बनिक एसिड लवण की दो पंक्तियों का निर्माण करता है: मध्यम - कार्बोनेट, उदाहरण के लिए, काको 3, और अम्लीय - बाइकार्बोनेट, उदाहरण के लिए, सीए (एचसीओ 3) 2। पानी में कार्बोनेट्स, पोटेशियम, सोडियम और अमोनियम के केवल नमक घुलनशील। एसिड लवण आमतौर पर पानी में घुलनशील होते हैं।
पानी की उपस्थिति में कार्बन डाइऑक्साइड से अधिक के साथ, कार्बोनेट को बाइकार्बोनेट में परिवर्तित किया जा सकता है। इसलिए, यदि कार्बन डाइऑक्साइड चूना पानी के माध्यम से पारित किया जाता है, तो यह पहले पानी के अघुलनशील कैल्शियम कार्बोनेट के कारण बादल छाएगा, लेकिन कार्बन डाइऑक्साइड के आगे गुजरने के साथ घुलनशील कैल्शियम बाइकार्बोनेट के गठन के कारण अशांति गायब हो जाती है:
सीएसीओ 3 + एच 2 ओ + एसओओ 2 = Са (НСО 3) 2।
यह इस नमक की उपस्थिति है जो पानी की अस्थायी कठोरता बताती है। अस्थायी क्यों? क्योंकि गर्म होने पर, घुलनशील कैल्शियम बाइकार्बोनेट फिर से अघुलनशील कार्बोनेट में परिवर्तित हो जाता है:
सीए (НСО 3) 2 = СаСо 3 ↓ + एन 2 0 + С0 2।
यह प्रतिक्रिया बॉयलर, स्टीम हीटिंग पाइप और घरेलू केटल्स की दीवारों पर घोटाले के गठन की ओर ले जाती है, और इस प्रतिक्रिया के परिणामस्वरूप प्रकृति में, गुफाओं से लटकते अजीब स्टालैक्टसाइट लटक रहे हैं, जिसकी ओर से स्टेलेग्माइट नीचे से बढ़ते हैं।
कैल्शियम और मैग्नीशियम के अन्य नमक, विशेष रूप से क्लोराइड और सल्फेट्स में, पानी को लगातार कठोरता देते हैं। उबलते पानी की स्थायी कठोरता को समाप्त नहीं किया जा सकता है। हमें एक और कार्बोनेट - सोडा का उपयोग करना है।
Na 2 सीओ 3, जो इन Ca 2+ आयनों को तलछट में परिवर्तित करता है, उदाहरण के लिए:
एल 2 + ना 2 सीओ 3 = CaCO 3 ↓ + 2NaCl।
अस्थायी पानी कठोरता को खत्म करने के लिए सोडा का भी इस्तेमाल किया जा सकता है।
एसिड समाधानों का उपयोग करके कार्बोनेट्स और बाइकार्बोनेट का पता लगाया जा सकता है: जब एसिड के संपर्क में आते हैं, तो मुक्त कार्बन डाइऑक्साइड के कारण एक विशेषता "उबलते" को देखा जाता है।
यह प्रतिक्रिया कार्बनिक एसिड के लवण के लिए गुणात्मक प्रतिक्रिया है।
निष्कर्ष
सभी सांसारिक जीवन कार्बन पर आधारित है। एक जीवित जीव का प्रत्येक अणु कार्बन कंकाल के आधार पर बनाया गया है। कार्बन परमाणु लगातार जीवमंडल के एक हिस्से (पृथ्वी के संकीर्ण खोल, जहां जीवन मौजूद है) से दूसरे स्थानांतरित हो जाते हैं। एक उदाहरण के रूप में प्रकृति में कार्बन चक्र का उपयोग करके, हम गतिशीलता में हमारे ग्रह पर जीवन की तस्वीर का पता लगा सकते हैं।
पृथ्वी पर मुख्य कार्बन भंडार वायुमंडल में कार्बन डाइऑक्साइड के रूप में होते हैं और महासागरों में भंग हो जाते हैं, यानी कार्बन डाइऑक्साइड (सीओ 2)। वायुमंडल में कार्बन डाइऑक्साइड अणुओं पर पहले विचार करें। पौधे इन अणुओं को अवशोषित करते हैं, फिर प्रकाश संश्लेषण की प्रक्रिया में, कार्बन परमाणु विभिन्न कार्बनिक यौगिकों में परिवर्तित हो जाता है और इस प्रकार पौधों की संरचना में शामिल किया जाता है। इसके अलावा, कई विकल्प हैं:
1. पौधे मरने तक कार्बन पौधों में रह सकते हैं। फिर उनके अणु विघटन करने वालों (जीवित कार्बनिक पदार्थों पर भोजन करने वाले जीवों और साथ ही साथ साधारण अकार्बनिक यौगिकों को नष्ट कर देते हैं), जैसे कि कवक और टमाटर के लिए भोजन में जाएंगे। आखिरकार, कार्बन वायुमंडल में सीओ 2 के रूप में वापस आ जाएगा;
2. पौधे जड़ी-बूटियों द्वारा खाया जा सकता है। इस मामले में, कार्बन या तो वायुमंडल में लौट जाएगा (जानवरों को सांस लेने की प्रक्रिया में और जब वे मृत्यु के बाद विघटित होते हैं), या जड़ी-बूटियों के जानवरों को मांसाहारियों द्वारा खाया जाएगा (और तब कार्बन फिर से वातावरण में वापस आ जाएगा);
3. पौधे मर सकते हैं और भूमिगत खत्म हो सकते हैं। फिर अंत में वे जीवाश्म ईंधन में बदल जाएंगे - उदाहरण के लिए, कोयले।
समुद्री जल में मूल सीओ 2 अणु के विघटन के मामले में, कई विकल्प भी संभव हैं:
कार्बन डाइऑक्साइड बस वातावरण में लौट सकता है (इस प्रकार के पारस्परिक गैस एक्सचेंज महासागरों और वायुमंडल के बीच हर समय होता है);
कार्बन समुद्री पौधों या जानवरों के ऊतकों में प्रवेश कर सकते हैं। फिर यह धीरे-धीरे महासागरों के तल पर तलछट के रूप में जमा हो जाएगा और अंततः चूना पत्थर में बदल जाएगा या तलछट से फिर से समुद्र के पानी में बदल जाएगा।
यदि कार्बन तलछट या जीवाश्म ईंधन का हिस्सा है, तो इसे वातावरण से हटा दिया जाता है। पृथ्वी के अस्तित्व के दौरान, कार्बन डाइऑक्साइड द्वारा हटाए गए कार्बन को प्रतिस्थापित किया गया था, जिसे ज्वालामुखीय विस्फोट और अन्य भू-तापीय प्रक्रियाओं के दौरान वातावरण में छोड़ दिया गया था। आधुनिक परिस्थितियों में, जीवाश्म ईंधन के मानव दहन से उत्सर्जन इन प्राकृतिक कारकों में भी जोड़ा जाता है। ग्रीन हाउस प्रभाव पर सीओ 2 के प्रभाव के कारण, कार्बन चक्र का अध्ययन वातावरण का अध्ययन करने वाले वैज्ञानिकों के लिए एक महत्वपूर्ण कार्य बन गया है।
इस खोज का एक हिस्सा पौधे के ऊतकों में पाया गया सीओ 2 की मात्रा का निर्धारण है (उदाहरण के लिए, एक नए लगाए गए जंगल में) - वैज्ञानिक इसे कार्बन सिंक कहते हैं। चूंकि विभिन्न देशों की सरकारें सीओ 2 उत्सर्जन को सीमित करने के लिए एक अंतरराष्ट्रीय समझौते तक पहुंचने की कोशिश कर रही हैं, इसलिए अलग-अलग राज्यों में सिंक और कार्बन उत्सर्जन के संतुलित अनुपात का मुद्दा औद्योगिक देशों के लिए विवाद की एक बड़ी हड्डी बन गया है। हालांकि, वैज्ञानिकों को संदेह है कि वायुमंडल में कार्बन डाइऑक्साइड का संचय केवल वृक्षारोपण से ही रोका जा सकता है।
बंद इंटरकनेक्टेड पथों के माध्यम से कार्बन लगातार स्थलीय जीवमंडल में फैल रहा है। वर्तमान में, जीवाश्म ईंधन जलने के प्रभाव प्राकृतिक प्रक्रियाओं में जोड़े गए हैं।
संदर्भ:
1. अख्तरोव एनएस रसायन विज्ञान ग्रेड 9: अध्ययन। सामान्य शिक्षा के लिए। प्रोक। संस्थानों। - दूसरा संस्करण। - एम।: शिक्षा, 1 999 - 175 पी .: इल।
2. गैब्रिएलियन ओएस रसायन विज्ञान ग्रेड 9: अध्ययन। सामान्य शिक्षा के लिए। प्रोक। संस्थानों। - चौथा संस्करण - एम।: ड्रोफा, 2001. - 224 पीपी।, बीमार।
3. गैब्रिएलियन ओएस रसायन विज्ञान ग्रेड 8-9: विधि। भत्ता। - चौथा संस्करण - एम।: ड्रोफा, 2001. - 128 पी।
4. इरोशिन डीपी, शिशकिन ईए। रसायन शास्त्र में समस्याओं को हल करने के तरीके: अध्ययन। भत्ता। - एम।: ज्ञान, 1 9 8 9। - 176 पीपी।, बीमार।
5. क्रेमेनचुग एम। रसायन विज्ञान: छात्र की पुस्तिका। - एम।: फिलोल। "शब्द" समाज: इज़द-वो एएसटी, एलएलसी, 2001. - 478 पी।
6. क्रिट्समैन वीए। अकार्बनिक रसायन शास्त्र पढ़ने के लिए बुक करें। - एम।: ज्ञान, 1 9 86 - 273 पी।