वर्तमान और वोल्टेज के लिए बिजली की गणना
जैसा कि आप जानते हैं, विद्युत वोल्टेज का अपना उपाय होना चाहिए, जो प्रारंभ में उस मूल्य से मेल खाता है जो ...
कार्बन।
कार्बन (कार्बोनेम), सी - समूह IV का रासायनिक तत्व, एक माध्यमिक उपसमूह, आवधिक प्रणाली की दूसरी अवधि डी मेंडेलेव, सीरियल नंबर 6. सापेक्ष परमाणु द्रव्यमान: 12,011। इलेक्ट्रोनगेटिविटी: 2.6। पिघलने बिंदु: 3370 डिग्री सेल्सियस (जलता है)। उबलते बिंदु: 4200єС। घनत्व (ग्रेफाइट): 2.27 ग्राम / सेमी। कार्बन खनिजों की संख्या 112 है; कार्बनिक कार्बन यौगिकों की संख्या - हाइड्रोकार्बन और उनके डेरिवेटिव - बहुत बड़े हैं। कार्बन मुक्त राज्य (हीरा, ग्रेफाइट के रूप में) और यौगिकों के रूप में (दहनशील शैलों, लिग्नाइट और बिटुमिनस कोयले, पीट और पेट्रोलियम में यौगिकों के रूप में, कार्बोनेट्स में प्राकृतिक दहनशील गैसों) के रूप में प्रकृति में पाया जाता है। सभी जीवित जीव कार्बन यौगिकों से बने होते हैं। कार्बन व्यापक है, लेकिन पृथ्वी की परत में इसकी सामग्री केवल 0.1 9% है; अंतरिक्ष में भी कार्बन व्यापक है; सूर्य पर, हाइड्रोजन, हीलियम और ऑक्सीजन के बाद यह चौथा स्थान लेता है। पृथ्वी की परत में औसत सामग्री की तुलना में, मानवता बहुत बड़ी मात्रा में कार्बन को गहराई (कोयले, तेल, प्राकृतिक गैस) से निकालती है, क्योंकि ये खनिज ऊर्जा का मुख्य स्रोत हैं।
ऐतिहासिक पृष्ठभूमि 1778 में, के। Scheele, नाइट्रेट के साथ हीटिंग ग्रेफाइट, पता चला कि कार्बोनेटेड नाइट्रेट गरम किया जा रहा था, कार्बन डाइऑक्साइड जारी किया गया था। हवा में जलने वाले हीरे और एस टेनेंट (17 9 7) के अध्ययनों के अध्ययन पर हीरा की रासायनिक संरचना ए लावोइसियर के प्रयोगों (1772) के परिणामस्वरूप स्थापित की गई थी, जिन्होंने साबित किया कि हीरा और कोयले की बराबर मात्रा ऑक्सीकरण के दौरान कार्बन डाइऑक्साइड की बराबर मात्रा में होती है। 178 9 में लावोइसियर द्वारा कार्बन को रासायनिक तत्व के रूप में पहचाना गया था। लैटिन नाम "कार्बोनेम" कार्बन "कार्बो" से लिया गया - कोयला। और 1 9 61 में, सैद्धांतिक और एप्लाइड कैमिस्ट्री (आईयूपीएसी) के अंतर्राष्ट्रीय संघों और भौतिकी में 12 सी कार्बन आइसोटोप का द्रव्यमान परमाणु द्रव्यमान की इकाई के रूप में द्रव्यमान प्राप्त हुआ, जो कि पहले मौजूद परमाणु द्रव्यमान के ऑक्सीजन पैमाने को समाप्त कर देता था। इस प्रणाली में कार्बन का परमाणु द्रव्यमान 12,011 है, क्योंकि यह तीन प्राकृतिक कार्बन आइसोटोपों के लिए औसत है, जो प्रकृति में उनकी बहुतायत को ध्यान में रखते हैं।
प्राचीन काल से कार्बन ज्ञात है। यह लंबे समय से ज्ञात है कि अन्य सामग्री को ग्रेफाइट के साथ लेबल किया जा सकता है, और 178 9 में ए वर्नर द्वारा ग्रीक शब्द का अर्थ "ग्रेफाइट" से लिया गया था। हालांकि, ग्रेफाइट का इतिहास भ्रमित है, अक्सर इसी तरह के बाहरी भौतिक गुणों वाले पदार्थों के साथ। , उदाहरण के लिए मोलिब्डेनाइट (मोलिब्डेनम सल्फाइड), एक समय में ग्रेफाइट माना जाता था। ग्रेफाइट के अन्य नामों में से "ब्लैक लीड", "कार्बाइड आयरन", "रजत लीड" कहा जाता है। 1779 में, के। Scheele ने स्थापित किया कि ग्रेफाइट कार्बन डाइऑक्साइड बनाने के लिए हवा द्वारा ऑक्सीकरण किया जा सकता है।
भारत में पहले ही हीरे का इस्तेमाल किया जाता था, और ब्राजील में, कीमती पत्थरों ने 1725 में वाणिज्यिक महत्व हासिल किया था; दक्षिण अफ्रीका में जमा 1867 में खोजी गई थी। 20 वीं शताब्दी में, हीरे के मुख्य उत्पादक दक्षिण अफ्रीका, ज़ैरे, बोत्सवाना, नामीबिया, अंगोला, सिएरा लियोन, तंजानिया और रूस हैं। कृत्रिम हीरे, जिसकी तकनीक 1 9 70 में बनाई गई थी, औद्योगिक उद्देश्यों के लिए बनाई गई है।
शारीरिक और रासायनिक गुण। चार क्रिस्टलीय कार्बन संशोधन ज्ञात हैं: ग्रेफाइट, हीरा, कार्बिन, और लोन्सडलाइट। सीसा - भूरे रंग के काले, अपारदर्शी, स्पर्श करने के लिए तेल, एक धातु शीशे के साथ बहुत नरम द्रव्यमान, विद्युत चालकता है। परमाणु परतों में परमाणुओं को व्यवस्थित किया जाता है, जो हेक्सागोनल जाली बनाते हैं। परत के अंदर, परमाणु एक परत के साथ एक परत से अधिक दृढ़ता से बंधे होते हैं, इसलिए ग्रेफाइट को स्तरीकृत किया जा सकता है। यह ऑक्सीजन की उपस्थिति में 700 डिग्री सेल्सियस पर जलता है। प्रकृति में होता है; यह कृत्रिम रूप से बाहर निकलता है। उच्च तापमान, दबाव और उत्प्रेरक की उपस्थिति (मैंगनीज एमएन, क्रोमियम सीआर, प्लैटिनम धातु) पर, ग्रेफाइट हीरे में बदल जाता है। हीरा - खनिज पीला, सफेद, भूरा, हरा, कम अक्सर नीला और काला रंग होता है। विद्युत प्रवाह का संचालन नहीं करता है, गर्मी खराब हो जाता है। एक क्रिस्टल में, कार्बन परमाणु एक निरंतर त्रि-आयामी ढांचे का निर्माण करते हैं जिसमें आकृतिबद्ध टेट्राहेड्रा होता है, जो उच्च बंधन शक्ति सुनिश्चित करता है। हीरा सबसे कठिन पदार्थ कभी ज्ञात है। 3500єС से ऊपर पिघलने बिंदु। रासायनिक प्रतिरोधी। यह ऑक्सीजन की उपस्थिति में 870 डिग्री सेल्सियस पर जलता है। ऑक्सीजन की अनुपस्थिति में 1800 єС पर यह ग्रेफाइट में बदल जाता है। साफ़ क्रिस्टल; प्रसंस्करण के बाद - हीरे। यह placers और प्राथमिक जमा से निकाला जाता है। उच्च दबाव और तापमान पर ग्रेफाइट से सिंथेटिक हीरा प्राप्त किया जाता है। यह अक्सर पारदर्शी या अपारदर्शी होता है; इसमें प्राकृतिक हीरे की क्रिस्टलीय संरचना और गुण हैं। तरल कार्बन 10.5 एमएन / एम 2 (105 किलोफ्राम / सेमी²) से अधिक दबाव और 3700 डिग्री सेल्सियस से अधिक तापमान पर प्राप्त किया जा सकता है। कोक, सूट, चारकोल ( ठोस कार्बन ) ग्रेफाइट के समान संरचना है। ठोस कार्बन के लिए, एक विकृत संरचना वाला एक राज्य भी विशेषता है - तथाकथित "असंगत" कार्बन जो आत्म-संशोधन नहीं है; इसकी संरचना के दिल में क्रिस्टलीय ग्रेफाइट की संरचना है। 1500-1600 єC से ऊपर "असंगत" कार्बन की कुछ किस्मों का ताप हवा के उपयोग के बिना ग्रेफाइट में उनके परिवर्तन का कारण बनता है। "असंगत" कार्बन के भौतिक गुण कणों के फैलाव और अशुद्धियों की उपस्थिति पर बहुत निर्भर हैं। घनत्व, गर्मी क्षमता, थर्मल चालकता और "असंगत" कार्बन की विद्युत चालकता हमेशा ग्रेफाइट से अधिक है। काबैन कृत्रिम रूप से प्राप्त किया। यह एक बढ़िया काला पाउडर (घनत्व = 2 जी / सेमी) है। सी परमाणुओं की लंबी श्रृंखलाओं से निर्मित एक दूसरे के समानांतर रखा गया। Lonsdale उल्कापिंडों और कृत्रिम रूप से प्राप्त में पाया; इसकी संरचना और गुण पूरी तरह से स्थापित नहीं हैं।

ए बी
हीरा की संरचना (ए) और ग्रेफाइट (बी)।
एक कार्बन परमाणु के बाहरी इलेक्ट्रॉन खोल की विन्यास 2sІ 2pІ । राज्य के बाहरी इलेक्ट्रॉन खोल की उत्तेजना के कारण कार्बन को चार सहसंयोजक बांड के गठन से चिह्नित किया जाता है 2spі । रासायनिक बंधन द्वारा किया जा सकता है एसपी3 -, एसपी2 - और एसपी- हाइब्रिड कक्षाएं, जो 4, 3, और 2 के समन्वय संख्याओं के अनुरूप होती हैं। कार्बन के वैलेंस इलेक्ट्रॉनों की संख्या और वैलेंस कक्षाओं की संख्या समान होती है; यह कार्बन परमाणुओं के बीच बंधन की स्थिरता के कारणों में से एक है।

कार्बन परमाणु की संरचना।
मजबूत और लंबी श्रृंखलाओं और चक्रों के गठन के साथ गठबंधन करने के लिए कार्बन परमाणुओं की अनूठी क्षमता ने जैविक रसायन शास्त्र द्वारा अध्ययन किए गए विभिन्न कार्बन यौगिकों (हाइड्रोकार्बन) की एक बड़ी संख्या का उदय किया है।
यौगिकों में, कार्बन ऑक्सीकरण राज्यों को प्रदर्शित करता है -4; 2; 4। परमाणु त्रिज्या 0.77 बी, क्रमशः त्रिज्या 0.77 बी, 0.67 बी, 0.60 बी, क्रमशः एकल, डबल और ट्रिपल बॉन्ड में; आयनिक त्रिज्या
सी 4 - 2.60 बी, सी 4 + 0.20 बी। सामान्य परिस्थितियों में, कार्बन रासायनिक रूप से निष्क्रिय होता है, उच्च तापमान पर यह कई तत्वों के साथ मिलकर मजबूत घटते गुण दिखाता है। श्रृंखला में रासायनिक गतिविधि घट जाती है: "असंगत" कार्बन, ग्रेफाइट, हीरा; कार्बन डाइऑक्साइड सीओ 2 और कार्बन मोनोऑक्साइड सीओ के गठन के साथ 300-500 डिग्री सेल्सियस, 600-700 डिग्री सेल्सियस और 850-1000 डिग्री सेल्सियस से ऊपर तापमान पर, ऑक्सी ऑक्सीजन (दहन) के साथ बातचीत क्रमशः होती है।
सीओ 2 कार्बनिक एसिड बनाने के लिए पानी में घुल जाता है। 1 9 06 में, ओ। डायल्स को कार्बन डाइऑक्साइड सी 3 ओ 2 मिला। कार्बन के सभी रूप क्षार और एसिड से प्रतिरोधी होते हैं और धीरे-धीरे बहुत मजबूत ऑक्सीकरण एजेंटों (क्रोमिक मिश्रण, केंद्रित एचएनओ 3 और केसीएलओ 3, आदि का मिश्रण) द्वारा ऑक्सीकरण किया जाता है। "असंगत" कार्बन प्रतिक्रिया करता है एक अधातु तत्त्व कमरे के तापमान, ग्रेफाइट और हीरे पर - गर्म होने पर। के साथ प्रत्यक्ष कार्बन यौगिक क्लोरीन एक विद्युत चाप में होता है; साथ ब्रोमिन और आयोडीन कार्बन प्रतिक्रिया नहीं करता है, इसलिए कई कार्बन हाइडिड्स परोक्ष रूप से संश्लेषित होते हैं। सामान्य सूत्र सीओएक्स 2 (जहां एक्स एक हलोजन है) के ऑक्सीहाइडिस में से सबसे अधिक जाना जाता है, क्लोरोक्साइड सीओसीएल 2 (फॉस्जीन)। हाइड्रोजन हीरा के साथ बातचीत नहीं करता है; ग्रेफाइट और "असंगत" कार्बन उत्प्रेरक (निकल नी, प्लैटिनम पीटी) की उपस्थिति में उच्च तापमान पर प्रतिक्रिया करता है: 600-1000 डिग्री सेल्सियस पर मुख्य रूप से मीथेन सीएच 4 का गठन होता है, 1500-2000 डिग्री सेल्सियस - एसिटिलीन सी 2 एच 2 पर, अन्य हाइड्रोकार्बन भी उत्पादों में मौजूद हो सकते हैं सी 2 एच 6, बेंजीन सी 6 एच 6। बातचीत गंधक "असंगत" कार्बन और ग्रेफाइट 700-800 डिग्री सेल्सियस से शुरू होता है, जिसमें हीरा 900-1000 डिग्री सेल्सियस पर होता है; सभी मामलों में कार्बन डाइसल्फाइड सीएस 2 का गठन होता है। सल्फर युक्त अन्य कार्बन यौगिक (सीएस थियोक्साइड, सी 3 एस 2 थियोनोक्साइड, सीओएस सल्फर ऑक्साइड, और सीएससीएल 2 थिओफोसिन) परोक्ष रूप से प्राप्त होते हैं। जब सीएस 2 धातु सल्फाइड के साथ बातचीत करता है, तो थियोकार्बोनेट बनते हैं - कमजोर थियोगोलिक एसिड के नमक। कार्बन बातचीत के साथ नाइट्रोजन सियान (सीएन) 2 का उत्पादन करने के लिए, यह नाइट्रोजन वायुमंडल में कार्बन इलेक्ट्रोड के बीच एक विद्युत निर्वहन पारित होता है। कार्बन के नाइट्रोजन युक्त यौगिकों में से, हाइड्रोजन साइनाइड एचसीएन और इसके कई डेरिवेटिव महत्वपूर्ण हैं: साइनाइड, हाइडिड्स, नाइट्रिल इत्यादि। 1000 डिग्री सेल्सियस से ऊपर तापमान पर, कार्बन कई लोगों के साथ बातचीत करता है धातुओं द्वाराकार्बाइड दे रहा है। मुक्त धातुओं (जेएन, सीडी, सीयू, पीबी, आदि) या कार्बाइड (सीएसी 2, एमओ 2 सी, डब्ल्यूसी, टीएसी, आदि) बनाने के लिए गर्म होने पर कार्बन के सभी रूप धातु ऑक्साइड को कम करते हैं। कार्बन 600-800 डिग्री सेल्सियस से ऊपर तापमान पर प्रतिक्रिया करता है पानी वाष्प और कार्बन डाइऑक्साइड। ग्रेफाइट की एक विशिष्ट विशेषता सी 8 एमई, सी 24 एमई, सी 8 एक्स (जहां एक्स हैलोजन, मी धातु है) को शामिल करने के लिए 300-400 єС तक मध्यम हीटिंग के साथ क्षार धातुओं और हाइडिड्स के साथ बातचीत करने की क्षमता है। ज्ञात यौगिकों में एचएनओ 3, एच 2 एसओ 4, FeCl3, और अन्य के साथ ग्रेफाइट शामिल है (उदाहरण के लिए, ग्रेफाइट बिसाल्फेट सी 24 एसओ 4 एच 2)। सामान्य अकार्बनिक और कार्बनिक में कार्बन के सभी रूप अघुलनशील होते हैं सॉल्वैंट्स, लेकिन कुछ पिघला हुआ धातुओं में घुल जाता है (उदाहरण के लिए, लौह फे, निकल नी, कोबाल्ट सह)।
कार्बन आइसोटोप। प्रकृति में, सात कार्बन आइसोटोप ज्ञात हैं, जिनमें से तीन एक महत्वपूर्ण भूमिका निभाते हैं। उनमें से दो स्थिर हैं, और एक स्थिर हैं, और एक है - रेडियोधर्मी (इसमें मानव शरीर में लगभग 0.1 होता है क्यूरी)। चयापचय और प्रकृति में कार्बन चक्र के अध्ययन में कई प्रमुख प्रगति जैविक और चिकित्सा अनुसंधान में कार्बन आइसोटोप के उपयोग से जुड़ी हुई है। इस प्रकार, रेडियोकार्बन चिह्न का उपयोग संभव फिक्सिंग N14SO3 पौधों और जानवरों के ऊतकों साबित कर दिया है, अनुक्रम प्रकाश संश्लेषण प्रतिक्रियाओं सेट अमीनो एसिड के आदान-प्रदान का अध्ययन किया है, कई जैविक रूप से सक्रिय यौगिकों के biosynthetic मार्ग का पता लगाया, और इतने पर। डी आवेदन 14C प्रोटीन जैवसंश्लेषण और हस्तांतरण के तंत्र का अध्ययन करने आणविक जीव विज्ञान के क्षेत्र में प्रगति के लिए योगदान दिया वंशानुगत जानकारी। कार्बन युक्त कार्बनिक अवशेषों में 14 सी की विशिष्ट गतिविधि का निर्धारण करना उनकी आयु का न्याय करना संभव बनाता है, जिसका उपयोग पालीटोलॉजी और पुरातत्व में किया जाता है।
शरीर में कार्बन। कार्बन - सबसे महत्वपूर्ण biogenic तत्व, जो पृथ्वी पर जीवन का आधार का गठन किया, जीवों और उनके चयापचय उपलब्ध कराने के निर्माण में लगा कार्बनिक यौगिकों की विशाल संख्या (बायोपॉलिमरों, साथ ही साथ कई छोटे अणु जैविक रूप से सक्रिय पदार्थों - विटामिन, हार्मोन, मध्यस्थों, आदि) के संरचनात्मक इकाई। कार्बन के ऑक्सीकरण के कारण जीवों द्वारा आवश्यक ऊर्जा का एक महत्वपूर्ण हिस्सा कोशिकाओं में उत्पादित होता है। पृथ्वी पर जीवन का उदय आधुनिक विज्ञान में कार्बन यौगिकों के विकास की जटिल प्रक्रिया के रूप में माना जाता है।
वन्यजीवन में कार्बन की भूमिका। जीवित प्रकृति में कार्बन की अनूठी भूमिका इसकी गुणों के कारण है, जो एक साथ आवधिक प्रणाली का कोई अन्य तत्व नहीं है। कार्बन परमाणुओं के साथ-साथ कार्बन और अन्य तत्वों के बीच, मजबूत रासायनिक बंधन बनते हैं, हालांकि, अपेक्षाकृत हल्के शारीरिक स्थितियों में तोड़ दिया जा सकता है (ये बंधन सिंगल, डबल या ट्रिपल हो सकते हैं)। अन्य कार्बन परमाणुओं के साथ 4 बराबर वैलेंस बॉन्ड बनाने के लिए कार्बन की क्षमता विभिन्न प्रकार के कार्बन कंकाल बनाने के लिए संभव बनाता है - रैखिक, ब्रांच, चक्रीय। यह महत्वपूर्ण है कि केवल तीन तत्व - कार्बन सी, ऑक्सीजन ओ और हाइड्रोजन एच - जीवित जीवों के कुल द्रव्यमान का 98% बनाते हैं। यह जीवित प्रकृति में एक निश्चित आर्थिक दक्षता प्राप्त करता है: कार्बन यौगिकों की लगभग असीमित संरचनात्मक विविधता के साथ, रासायनिक बंधनों की एक छोटी संख्या कार्बनिक पदार्थों के विभाजन और संश्लेषण के लिए आवश्यक एंजाइमों की संख्या को कम कर सकती है। कार्बन परमाणुओं की संरचनात्मक विशेषताएं समाजिक कार्बनिक यौगिकों (क्षमता ऑप्टिकल आइसोमरों, कार्बोहाइड्रेट और कुछ एल्कलॉइड के लिए अमीनो एसिड के जैव रासायनिक विकास में महत्वपूर्ण था) के विभिन्न प्रकार के आधार के रूप में।
ए। ओपेरिन की आम तौर पर स्वीकृत परिकल्पना के अनुसार, पृथ्वी पर पहले कार्बनिक यौगिक abiogenic उत्पत्ति के थे। कार्बन स्रोत पृथ्वी के प्राथमिक वातावरण में निहित मीथेन (सीएच 4) और हाइड्रोजन साइनाइड (एचसीएन) थे। जीवन के उद्भव के साथ, अकार्बनिक कार्बन का एकमात्र स्रोत, जिसके कारण जैवमंडल का सभी कार्बनिक पदार्थ बनता है, वायुमंडल में कार्बन डाइऑक्साइड (सीओ 2) है, साथ ही प्राकृतिक जल में एचसीओ -3 के रूप में भंग किया जाता है। कार्बन के एसिमिलेशन (एसिमिलेशन) का सबसे शक्तिशाली तंत्र (सीओ 2 के रूप में) - प्रकाश संश्लेषण - हरी पौधों द्वारा हर जगह किया जाता है (लगभग 100 बिलियन टन सीओ 2 सालाना समेकित होते हैं)। पृथ्वी पर, केमोसिनथेसिस द्वारा सीओ 2 को आत्मसात करने का एक विकासशील और प्राचीन तरीका है; इस मामले में, केमोसिंथेटिक्स सूक्ष्मजीव सूर्य की चमकदार ऊर्जा का उपयोग नहीं करते हैं, लेकिन अकार्बनिक यौगिकों की ऑक्सीकरण ऊर्जा का उपयोग करते हैं। अधिकांश जानवर कार्बन को तैयार कार्बनिक यौगिकों के रूप में भोजन से उपभोग करते हैं। कार्बनिक यौगिकों के आकलन के तरीके के आधार पर, यह ऑटोोट्रोफिक जीवों और हेटरोट्रोफिक जीवों को अलग करने के लिए प्रथागत है। बायोसिंथेसिस के लिए सूक्ष्मजीवों के प्रोटीन और अन्य पोषक तत्वों का उपयोग, जो एकमात्र कार्बन स्रोत के रूप में पेट्रोलियम हाइड्रोकार्बन का उपयोग करते हैं, महत्वपूर्ण आधुनिक वैज्ञानिक और तकनीकी समस्याओं में से एक है।
मुख्य कार्य के अलावा - कार्बन का स्रोत - कार्बन डाइऑक्साइड सीओ 2, प्राकृतिक जल में और जैविक तरल पदार्थ में भंग, पर्यावरण की अम्लता को बनाए रखने में शामिल है जो महत्वपूर्ण प्रक्रियाओं के लिए अनुकूल है। CaCO3 की संरचना में, कार्बन कई अपरिवर्तकों (उदाहरण के लिए, मोलुस्क गोले) के बाहरी कंकाल बनाता है, और कोरल, अंडेहेल पक्षियों आदि में भी पाया जाता है। एचसीएन, सीओ, सीसीएल 4 जैसे कार्बन यौगिकों, जो पृथ्वी के प्राथमिक वातावरण में प्रचलित हैं , जैविक विकास की प्रक्रिया में, मजबूत चयापचय antimetabolites में बदल गया।
कार्बन चक्र। कार्बन मुख्य पोषक तत्व है; यह जीवमंडल के जीवित पदार्थ के गठन में एक महत्वपूर्ण भूमिका निभाता है। हरे पौधों द्वारा किए गए प्रकाश संश्लेषण की प्रक्रिया में वायुमंडल से कार्बन डाइऑक्साइड, पौधों के एक विविध और कई कार्बनिक यौगिकों को जोड़ता है और बदल जाता है। असाधारण प्रजनन दर के कारण संयंत्र जीव, विशेष रूप से निचले सूक्ष्मजीव, समुद्री फाइटोप्लांकटन, प्रति वर्ष जैविक द्रव्यमान के रूप में लगभग 1.5 · 10 carbon टन कार्बन का उत्पादन करते हैं, जो कि संबंधित है
ऊर्जा के 5.86 · 10Іє जे (1.4 · 10Ієcal)। पौधों को आंशिक रूप से जानवरों द्वारा खाया जाता है (अधिक या कम जटिल खाद्य श्रृंखलाओं के गठन के साथ)। आखिरकार, जीवों के श्वसन के परिणामस्वरूप जैविक पदार्थ, उनके शवों, किण्वन, क्षय और दहन प्रक्रियाओं का अपघटन कार्बन डाइऑक्साइड में बदल जाता है या सैप्रोपेल, आर्द्रता, पीट के रूप में जमा किया जाता है, जो बदले में, कई अन्य कैस्टोबियोलिथ - कोयले, तेल, दहनशील गैसों।

कार्बन चक्र।
कार्बनिक पदार्थों और उनके खनिज के अपघटन की प्रक्रियाओं में, जीवाणु एक बड़ी भूमिका निभाते हैं (उदाहरण के लिए, पुट्रेक्टिव), साथ ही साथ कई कवक (उदाहरण के लिए, मोल्ड कवक)।
अपने पूरे द्रव्यमान का एक बहुत छोटा हिस्सा सक्रिय कार्बन चक्र में भाग लेता है। जीवाश्म चूना पत्थर और अन्य चट्टानों के रूप में कार्बनिक एसिड की एक बड़ी मात्रा में डिब्बाबंद। बदले में, वायुमंडल और महासागर के कार्बन डाइऑक्साइड के बीच एक चलती समतोल है।
तालिका: पृथ्वी की सतह पर और पृथ्वी की परत पर कार्बन सामग्री (16 किमी बिजली)
टी जी 1 पर देखनापृथ्वी की सतह
पशु 5 · 109 0.0015
पौधे 5 · 10№№ 0,1
वायुमंडल 6.4 · 10№№ 0.125
महासागर 3.8 · 10№ 7.5
भारी क्रिस्टलीय
चट्टानों: बेसल और अन्य। 1.7 · 1014 33.0
मुख्य नस्ल
ग्रेनाइट्स, granodiorites 2.9 · 1015 567
कोयले, तेल और अन्य
caustobioliths 6.4 · 1015 663
क्रिस्टल स्किस्ट 1 · 1016 2000
कार्बोनेट 1.3 · 1016 2500
कुल 3.2 · 1016 5770
कई जलीय जीव कैल्शियम कार्बोनेट को अवशोषित करते हैं, अपने कंकाल बनाते हैं, और फिर वे चूना पत्थर की परतें बनाते हैं। वायुमंडल निकाला गया था और फिलहाल हजारों गुना अधिक कार्बन डाइऑक्साइड दफनाया गया था। कार्बनिक डाइऑक्साइड के साथ वायुमंडल को कार्बनिक पदार्थ, कार्बोनेट इत्यादि के अपघटन की प्रक्रियाओं के कारण भर दिया जाता है, और साथ ही, मनुष्यों की औद्योगिक गतिविधि के परिणामस्वरूप, तेजी से। एक विशेष रूप से शक्तिशाली स्रोत ज्वालामुखी है, जिनमें से गैस मुख्य रूप से कार्बन डाइऑक्साइड और जल वाष्प शामिल होते हैं। ज्वालामुखी से निकले कार्बन डाइऑक्साइड और पानी में से कुछ तलछट चट्टानों, विशेष रूप से चूना पत्थर से पुनर्जन्म लेते हैं, जब मैग्मा उनके संपर्क में आता है और मैग्मा द्वारा उनके आकलन होता है। कार्बन परिसंचरण की प्रक्रिया में, इसे जैविक पदार्थ (कोयले, तेल, ऊतक, जीव, आदि) के जैव-रासायनिक गठन के दौरान, विशेष रूप से मैग्मैटिक प्रक्रिया (सीओ 2, हीरे, कार्बोनेट्स का गठन) में अपनी आइसोटोपिक संरचना (संख्या आईसी - संख्या सी) द्वारा बार-बार विभाजित किया जाता है।
कार्बन का उपयोग सरल पदार्थों के रूप में कार्बन का व्यापक रूप से उपयोग किया जाता है। अनमोल हीरा गहने का विषय है; ओपेक हीरा एक मूल्यवान घर्षण है, साथ ही साथ incisors और अन्य उपकरणों के निर्माण के लिए सामग्री है। लकड़ी का कोयला और कार्बन के अन्य असंगत रूपों का उपयोग प्रौद्योगिकी के क्षेत्रों में ब्लीचिंग, सफाई, गैस शोषण के लिए किया जाता है, जहां विकसित सतह वाले adsorbents की आवश्यकता होती है। सीसा पिघलने वाले क्रूसिबल, अस्तर प्लेट्स, इलेक्ट्रोड, ठोस लुब्रिकेंट्स के निर्माण के लिए उपयोग किया जाता है; रॉकेट प्रौद्योगिकी में; परमाणु रिएक्टरों में एक न्यूट्रॉन मॉडरेटर के रूप में; arandas के लिए छड़ के निर्माण के लिए घटक संरचना; हीरे के लिए; फिलर प्लास्टिक। कोयला कोक एक ईंधन के रूप में लौह धातु विज्ञान में प्रयोग किया जाता है और विस्फोट भट्टियों और कपोल भट्टियों में अपवर्तक होता है। पेट्रोलियम और इलेक्ट्रोड पिच कोक को कोयले और ग्रेफाइज्ड इलेक्ट्रोड बनाने के लिए प्रयोग किया जाता है, जो अक्सर ईंधन के रूप में कम होता है। कालिख (कार्बन ब्लैक) रबर और प्लास्टिक के निर्माण में एक भराव के रूप में प्रयोग किया जाता है; पेंट उद्योग में वर्णक; इलेक्ट्रोड के निर्माण के लिए, इत्यादि। carbides, धातुओं के साथ कार्बन के यौगिकों के साथ-साथ बोरॉन और सिलिकॉन (उदाहरण के लिए, अल 4 सी 3, सीआईसी, बी 4 सी) उच्च कठोरता से अलग होते हैं और घर्षण और काटने के उपकरण बनाने के लिए उपयोग किए जाते हैं। कार्बन अपने ऑक्साइड से धातुओं का उत्पादन करने के लिए प्रयोग किया जाता है। कार्बन मूल राज्य में और कार्बाइड के रूप में स्टील और मिश्र धातु का हिस्सा है। उच्च तापमान (सीमेंटेशन) पर कार्बन के साथ स्टील कास्टिंग की सतह की संतृप्ति सतह की कठोरता को बढ़ाती है और प्रतिरोध पहनती है।

आभूषण में हीरा,
पेंसिल में ग्रेफाइट।
संदर्भ:1) "बिग स्कूल एनसाइक्लोपीडिया", खंड 2, संस्करण। "Olma-प्रेस"
2) इंटरनेट: www.encycl.yandex, www.krugosvet, wwwrmika।
लगातार दो दशकों तक, कोयले तेल की उछाल की छाया में रहा है। कोयले के पहाड़ जो बेचते नहीं थे आसमान में बढ़े। कई खानों ने बंद कर दिया, सैकड़ों हजारों खनिकों ने अपनी नौकरियां खो दीं। संयुक्त राज्य अमेरिका के एपलाचियन क्षेत्र, एक बार बढ़ते कोयले बेसिन, गरीबी के सबसे उदास क्षेत्रों में से एक बन गया है ...
आवधिक प्रणाली में हाइड्रोजन परमाणु की संरचना। ऑक्सीकरण की डिग्री। प्रकृति में प्रचलन। एक साधारण पदार्थ के रूप में हाइड्रोजन, जिसमें अणुओं को एक सहसंयोजक गैर-ध्रुवीय बंधन द्वारा एक साथ जुड़े दो परमाणु होते हैं। शारीरिक और रासायनिक गुण।
हीरा। "हीरा" शब्द तुरंत खजाने वाले शिकार कहानियों के बारे में बताते हुए रहस्यमय कहानियों को याद करता है। कभी-कभी जो लोग हीरे की शिकार कर रहे थे, उन्हें संदेह नहीं था कि उनका जुनून क्रिस्टलीय कार्बन था - बहुत कार्बन जो सूट, सूट और कोयला बनाता है। .Pe ...
कार्बन के बारे में जानकारी, पुरातनता और प्रकृति में इसके वितरण से पहले डेटिंग। परत में कार्बन की उपस्थिति। कार्बन के भौतिक और रासायनिक गुण। कार्बन और इसके यौगिकों का उत्पादन और उपयोग। सक्रिय कार्बन की adsorption क्षमता।
साधारण पदार्थों के रासायनिक गुण। कार्बन और सिलिकॉन के बारे में सामान्य जानकारी। कार्बन के रासायनिक यौगिक, इसके ऑक्सीजन और नाइट्रोजन युक्त डेरिवेटिव। पानी और घुलनशील एसिड में कार्बाइड, घुलनशील और अघुलनशील। ऑक्सीजनयुक्त सिलिकॉन यौगिकों।
कार्बन (सी) - ठेठ गैर धातु; आवधिक प्रणाली में दूसरी अवधि IV समूह, मुख्य उपसमूह में है। अनुक्रम संख्या 6, आर = 12,011 एमयू, परमाणु शुल्क +6।भौतिक गुण: कार्बन कई आलोट्रोपिक संशोधन बनाता है: हीरा - सबसे कठिन पदार्थों में से एक ग्रेफाइट, कोयला, सूट.
कार्बन परमाणु में 6 इलेक्ट्रॉन हैं: 1 एस 2 2 एस 2 2 पी 2 . पिछले दो इलेक्ट्रॉन अलग-अलग पी-कक्षाओं पर स्थित हैं और अनपेक्षित हैं। सिद्धांत रूप में, यह जोड़ी एक कक्षीय पर कब्जा कर सकती है, लेकिन इस मामले में इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकृति बहुत बढ़ जाती है। इस कारण से, उनमें से एक 2 पी एक्स, और दूसरा, या 2 पी वाई लेता है , या 2 पी जेड-कक्षाएं।
बाहरी परत के एस- और पी-सबलेवल की ऊर्जा के बीच का अंतर छोटा है, इसलिए परमाणु आसानी से उत्साहित स्थिति में गुजरता है, जिसमें 2 एस कक्षाओं के दो इलेक्ट्रॉनों में से एक मुक्त हो जाता है 2p। एक वैलेंस स्थिति कॉन्फ़िगरेशन 1s 2 2s 1 2p x 1 2p y 1 2p z 1 होता है . यह कार्बन परमाणु की स्थिति है जो हीरा जाली की विशेषता है - हाइब्रिड कक्षाओं की टेट्राहेड्रल स्थानिक व्यवस्था, समान लंबाई और बंधन ऊर्जा।
इस घटना को बुलाया जाना जाता है एसपी 3 संकरण और परिणामी कार्यों एसपी 3 संकर हैं . चार एसपी 3 बॉन्ड का गठन तीन से अधिक स्थिर कार्बन परमाणु प्रदान करता है पी-पी और एक एस-एस कनेक्शन। कार्बन परमाणु में एसपी 3 संकरण के अलावा, एसपी 2 और एसपी संकरण भी मनाया जाता है। . पहले मामले में, आपसी ओवरलैप होता है। s- और दो पी-कक्षाएं। तीन समकक्ष एसपी 2 - हाइब्रिड कक्षाएं एक ही विमान में एक दूसरे से 120 डिग्री के कोण पर स्थित होती हैं। तीसरा कक्षीय पी अपरिवर्तित है और विमान के लिए लंबवत निर्देशित है। एसपी 2।

एसपी संकरण के साथ, एस या पी कक्षाएं अतिसंवेदनशील हैं। 180 डिग्री का कोण दो समकक्ष संकर कक्षाओं के बीच उत्पन्न होता है, जिसमें प्रत्येक परमाणु पर दो पी कक्षाएं अपरिवर्तित बनी रहती हैं।
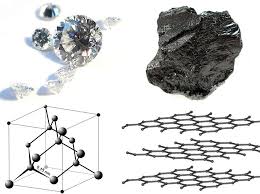
कार्बन आवंटन। डायमंड और ग्रेफाइट
एक ग्रेफाइट क्रिस्टल में, कार्बन परमाणु समानांतर विमानों में स्थित होते हैं, नियमित हेक्सागोन के शिखर पर कब्जा करते हैं। कार्बन परमाणुओं में से प्रत्येक तीन आसन्न एसपी 2 हाइब्रिड बॉन्ड से जुड़ा हुआ है। समानांतर विमानों के बीच कनेक्शन वैन डेर वाल्स बलों के कारण है। प्रत्येक परमाणु के मुक्त पी-कक्षाओं को सहसंयोजक बांड के विमानों के लिए लंबवत निर्देशित किया जाता है। उनका ओवरलैप कार्बन परमाणुओं के बीच अतिरिक्त π-bond बताता है। तो से वैलेंस राज्य जिसमें कार्बन परमाणु पदार्थ पदार्थ में होते हैं, इस पदार्थ के गुणों पर निर्भर करता है.
सबसे विशिष्ट ऑक्सीकरण राज्य हैं: +4, +2।
कम तापमान पर, कार्बन निष्क्रिय होता है, लेकिन गर्म होने पर, इसकी गतिविधि बढ़ जाती है।
- ऑक्सीजन के साथ
सी 0 + ओ 2 - टी ° = सीओ 2 कार्बन डाइऑक्साइड
ऑक्सीजन की कमी के साथ - अपूर्ण दहन:
2 सी 0 + ओ 2 - टी ° = 2 सी +2 ओ कार्बन मोनोऑक्साइड
फ्लूराइन के साथ
सी + 2 एफ 2 = सीएफ 4
- पानी वाष्प के साथ
सी 0 + एच 2 ओ - 1200 डिग्री = सी +2 ओ + एच 2 पानी गैस
- धातु ऑक्साइड के साथ। इस प्रकार अयस्क से धातु गले लगाया।
सी 0 + 2 क्यूओ - टी ° = 2 क्यू + सी +4 ओ 2
- एसिड के साथ - ऑक्सीकरण एजेंट:
सी 0 + 2 एच 2 एसओ 4 (कॉन्स।) = सी + 4 ओ 2 + 2 एसओ 2 + 2 एच 2 ओ
सी 0 + 4HNO 3 (कॉन्स।) = सी + 4 ओ 2 + 4NO 2 + 2 एच 2 ओ
- सल्फर के साथ कार्बन डाइसल्फाइड बनाते हैं:
सी + 2 एस 2 = सीएस 2।
- कुछ धातुओं के साथ कार्बाइड बनाता है
4 एएल + 3 सी 0 = अल 4 सी 3
सीए + 2 सी 0 = सीएसी 2 -4
- हाइड्रोजन के साथ - मीथेन (साथ ही कार्बनिक यौगिकों की एक बड़ी मात्रा)
सी 0 + 2 एच 2 = सीएच 4
- सिलिकॉन के साथ, कार्बोन्डंडम (2000 डिग्री सेल्सियस पर एक इलेक्ट्रिक फर्नेस में) बनाता है:
हीरा और ग्रेफाइट के रूप में नि: शुल्क कार्बन पाया जाता है। यौगिकों के रूप में, कार्बन खनिजों की संरचना में पाया जाता है: चाक, संगमरमर, चूना पत्थर - काको 3, डोलोमाइट - एमजीसीओ 3 * CaCO 3; हाइड्रोकार्बोनेट्स - एमजी (एचसीओ 3) 2 और सीए (एचसीओ 3) 2, सीओ 2 हवा का हिस्सा है; कार्बन प्राकृतिक कार्बनिक यौगिकों का मुख्य घटक है - गैस, तेल, कोयले, पीट, कार्बनिक पदार्थ, प्रोटीन, वसा, कार्बोहाइड्रेट, एमिनो एसिड का हिस्सा है जो जीवित जीव बनाते हैं।

न तो सी 4+ आयन और न ही सी 4- किसी भी पारंपरिक रासायनिक प्रक्रियाओं के तहत गठित होते हैं: कार्बन यौगिकों में विभिन्न ध्रुवीयता के सहसंयोजक बंधन होते हैं।
कार्बन मोनोऑक्साइड; पानीहीन, गंध रहित, पानी में थोड़ा घुलनशील, कार्बनिक सॉल्वैंट्स में घुलनशील, जहरीला, टी ° कीप = -192 डिग्री सेल्सियस; टी पीएल = -205 डिग्री सेल्सियस
स्वागत
1) उद्योग में (गैस जेनरेटर में):
सी + ओ 2 = सीओ 2
2) प्रयोगशाला में - एच 2 एसओ 4 (कॉन्स।) की उपस्थिति में फॉर्मिक या ऑक्सीलिक एसिड के थर्मल अपघटन द्वारा:
एचसीओएचएच = एच 2 ओ + सीओ
एच 2 सी 2 ओ 4 = सीओ + सीओ 2 + एच 2 ओ
रासायनिक गुण
सामान्य परिस्थितियों में, सीओ निष्क्रिय है; गर्म होने पर - एक घटता एजेंट; गैर-गठन ऑक्साइड।
1) ऑक्सीजन के साथ
2 सी + 2 ओ + ओ 2 = 2 सी + 4 ओ 2
2) धातु ऑक्साइड के साथ
सी + 2 ओ + क्यूओ = सीयू + सी + 4 ओ 2
3) क्लोरीन के साथ (प्रकाश में)
सीओ + सीएल 2 - एचएन = सीओसीएल 2 (फॉस्जीन)
4) क्षार पिघलने (दबाव में) के साथ प्रतिक्रिया करता है
सीओ + NaOH = HCOONA (सोडियम फॉर्मेट)
5) संक्रमण धातुओं के साथ carbonyls फार्म
नी + 4CO - टी ° = नी (सीओ) 4
Fe + 5CO - टी ° = Fe (सीओ) 5
पानी में कार्बन डाइऑक्साइड, रंगहीन, गंध रहित, घुलनशीलता - 0.9VCO2 1V एच 2 ओ (सामान्य परिस्थितियों में) में घुल जाती है; हवा से भारी; टी ° pl। = -78.5 डिग्री सेल्सियस (ठोस सीओ 2 को "शुष्क बर्फ" कहा जाता है); जलने का समर्थन नहीं करता है।
स्वागत
CaCO 3 - टी ° = CaO + सीओ 2
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
NaHCO 3 + एचसीएल = NaCl + एच 2 ओ + सीओ 2
रासायनिकगुणसीओ2
एसिड ऑक्साइड: कार्बनिक एसिड लवण बनाने के लिए मूल ऑक्साइड और अड्डों के साथ प्रतिक्रिया करता है
ना 2 ओ + सीओ 2 = ना 2 सीओ 3
2 एनओओएच + सीओ 2 = ना 2 सीओ 3 + एच 2 ओ
NaOH + सीओ 2 = NaHCO 3
ऊंचे तापमान पर ऑक्सीडेटिव गुण प्रदर्शित हो सकते हैं।
एस +4 ओ 2 + 2 एमजी - टी ° = 2 एमजी +2 ओ + सी 0
योग्यता प्रतिक्रिया
नींबू अशांति:
सीए (ओएच) 2 + सीओ 2 = CaCO 3 ¯ (सफेद precipitate) + एच 2 ओ
चूंकि चूने के पानी के माध्यम से सीओ 2 के लंबे ट्रांसमिशन के साथ गायब हो जाता है अघुलनशील कैल्शियम कार्बोनेट घुलनशील बाइकार्बोनेट में चला जाता है:
काको 3 + एच 2 ओ + सीओ 2 = सीए (एचसीओ 3) 2
एच 2सीओ 3 -एसिड कमजोर है, केवल जलीय घोल में मौजूद है:
सीओ 2 + एच 2 ओ ↔ एच 2 सीओ 3
द्विक्षारकीय:
एच 2 सीओ 3 ↔ एच + + एचसीओ 3 - एसिड लवण - बाइकार्बोनेट्स, बाइकार्बोनेट्स
एचसीओ 3 - ↔ एच + + सीओ 3 2- मध्य लवण - कार्बोनेट्स
एसिड के सभी गुण विशेषता हैं।
कार्बोनेट और बाइकार्बोनेट एक-दूसरे में बदल सकते हैं:
2 नाहको 3 - टी ° = ना 2 सीओ 3 + एच 2 ओ + सीओ 2
ना 2 सीओ 3 + एच 2 ओ + सीओ 2 = 2 नाहको 3
ऑक्साइड बनाने के लिए गर्म होने पर धातु कार्बोनेट (क्षार धातुओं को छोड़कर) decarboxylate:
क्यूको 3 - टी ° = क्यूओ + सीओ 2
योग्यता प्रतिक्रिया - एक मजबूत एसिड की कार्रवाई के तहत "उबलते":
Na 2 सीओ 3 + 2 एचसीएल = 2 एनएसीएल + एच 2 ओ + सीओ 2
सीओ 3 2- + 2 एच + = एच 2 ओ + सीओ 2
कैल्शियम कार्बाइड:
CaO + 3 सी = सीएसी 2 + सीओ
सीएसी 2 + 2 एच 2 ओ = सीए (ओएच) 2 + सी 2 एच 2।
जिंक, कैडमियम, लान्थेनम और सेरियम कार्बाइड पानी के साथ प्रतिक्रिया करते समय एसिटिलीन जारी किया जाता है:
2 लाइक 2 + 6 एच 2 ओ = 2 एलए (ओएच) 3 + 2 सी 2 एच 2 + एच 2।
2 सी और अल 4 सी 3 मीथेन बनाने के लिए पानी के साथ विघटित हो:
अल 4 सी 3 + 12 एच 2 ओ = 4 अल (ओएच) 3 = 3 सीएच 4।
तकनीक टाइटेनियम कार्बाइड टीआईसी, टंगस्टन डब्ल्यू 2 सी (हार्ड मिश्र धातु), सिलिकॉन सीआईसी (कार्बोन्डंडम - एक घर्षण और हीटर के लिए सामग्री के रूप में) का उपयोग करती है।
अमोनिया और कार्बन मोनोऑक्साइड के वातावरण में सोडा को गर्म करके प्राप्त किया गया:
ना 2 सीओ 3 + 2 एनएच 3 + 3 सीओ = 2 NaCN + 2 एच 2 ओ + एच 2 + 2 सीओ 2
हाइड्रोसायनिक एसिड एचसीएन - रासायनिक उद्योग का एक महत्वपूर्ण उत्पाद, कार्बनिक संश्लेषण में व्यापक रूप से प्रयोग किया जाता है। इसका विश्व उत्पादन प्रति वर्ष 200 हजार टन तक पहुंचता है। साइनाइड आयन की इलेक्ट्रॉनिक संरचना कार्बन मोनोऑक्साइड (द्वितीय) के समान है, ऐसे कणों को isoelectronic कहा जाता है:
सी = ओ: [सी = एन:] -
सोना खनन में साइनाइड (0.1-0.2% जलीय घोल) का उपयोग किया जाता है:
2 औ + 4 केसीएन + एच 2 ओ + 0.5 ओ 2 = 2 के + 2 केओएच।
जब सल्फर या फ्यूजिंग ठोस के साथ साइनाइड के उबलते समाधान बनते हैं thiocyanates:
केसीएन + एस = केएससीएन।
कम सक्रिय धातुओं के साइनाइड को गर्म करते समय, डायलिसन प्राप्त होता है: एचजी (सीएन) 2 = एचजी + (सीएन) 2। साइनाइड समाधान ऑक्सीकरण कर रहे हैं cyanate:
2 केसीएन + ओ 2 = 2 केओसीएन।
साइनिक एसिड दो रूपों में मौजूद है:
एचएन = सी = ओ; H-O-सी = न:
1828 में, फ्रेडरिक वोहलर (1800-1882) ने अमोनियम साइनेट से यूरिया प्राप्त किया: एनएच 4 ओसीएन = सीओ (एनएच 2) 2 जब जलीय घोल वाष्पित हो गया था।
इस घटना को आमतौर पर सिंथेटिक रसायन शास्त्र के लिए "जीवनशैली सिद्धांत" पर विजय के रूप में देखा जाता है।
एक साइनीक आइसोमर है - अस्थिर एसिड
एच-ओ-एन = सी।
इसके लवण (झटके पारा एचजी (ओएनसी) 2) शॉक igniters में उपयोग किया जाता है।
संश्लेषण यूरिया (यूरिया):
सीओ 2 + 2 एनएच 3 = सीओ (एनएच 2) 2 + एच 2 ओ। 130 0 एस और 100 एटीएम पर।
यूरिया कार्बनिक एसिड अमाइड है, और इसका "नाइट्रोजन एनालॉग", गुआनाइडिन मौजूद है।
सबसे महत्वपूर्ण अकार्बनिक कार्बन यौगिक कार्बोनेट नमक (कार्बोनेट) हैं। एच 2 सीओ 3 एक कमजोर एसिड है (के 1 = 1.3 · 10 -4; के 2 = 5 · 10 -11)। कार्बोनेट बफर का समर्थन करता है कार्बन डाइऑक्साइड संतुलन वातावरण में महासागर में एक बड़ी बफर क्षमता है क्योंकि यह एक खुली प्रणाली है। कार्बनिक एसिड के विघटन के दौरान मुख्य बफर प्रतिक्रिया संतुलन है:
एच 2 सीओ 3 ↔ एच + + एचसीओ 3 -।
अम्लता में कमी के साथ, वातावरण से कार्बन डाइऑक्साइड का अतिरिक्त अवशोषण एसिड के गठन के साथ होता है:
सीओ 2 + एच 2 ओ ↔ एच 2 सीओ 3।
अम्लता में वृद्धि के साथ, कार्बोनेट चट्टानों को भंग कर दिया जाता है (समुद्र में गोले, क्रेटेसियस और चूना पत्थर जमा); यह बाइकार्बोनेट आयनों के नुकसान की भरपाई करता है:
एच + + सीओ 3 2- ↔ एचसीओ 3 -
काको 3 (टीवी) ↔ सीए 2+ + सीओ 3 2-
ठोस कार्बोनेट घुलनशील बाइकार्बोनेट में परिवर्तित हो जाते हैं। यह कार्बन डाइऑक्साइड द्वारा पृथ्वी के थर्मल विकिरण के अवशोषण के कारण "कार्बन डाइऑक्साइड" के रासायनिक विघटन की प्रक्रिया है जो "ग्रीनहाउस प्रभाव" का प्रतिरोध करता है - ग्लोबल वार्मिंग। ग्लास उत्पादन में वैश्विक सोडा उत्पादन (सोडियम कार्बोनेट ना 2 सीओ 3) का लगभग एक तिहाई उपयोग किया जाता है।
दृढ़ संकल्प
कार्बन - आवर्त सारणी का छठा तत्व। पदनाम - लैटिन "कार्बोनेम" से सी। दूसरी अवधि में, आईवीए समूह में स्थित है। गैर धातुओं को संदर्भित करता है। कोर चार्ज 6 है।
कार्बन अपने मुक्त राज्य और कई यौगिकों के रूप में प्रकृति में पाया जाता है। हीरा और ग्रेफाइट के रूप में नि: शुल्क कार्बन पाया जाता है। जीवाश्म कोयला के अलावा, पृथ्वी की गहराई में तेल के बड़े संचय होते हैं। क्रस्ट में कार्बनिक एसिड, विशेष रूप से कैल्शियम कार्बोनेट की बड़ी मात्रा में लवण पाए जाते हैं। हवा में हमेशा कार्बन डाइऑक्साइड होता है। अंत में, कार्बन भाग लेने के गठन में पदार्थों और पशु जीव पदार्थों से बना होते हैं। इस प्रकार, यह तत्व पृथ्वी पर सबसे आम है, हालांकि इसकी कुल सामग्री केवल 0.1% (द्रव्यमान) है।
एक पदार्थ (एमआर) का सापेक्ष आणविक द्रव्यमान एक संख्या है जो दिखाता है कि दिए गए अणु का द्रव्यमान कार्बन परमाणु के द्रव्यमान के 1/12 से अधिक है, और तत्व के सापेक्ष परमाणु द्रव्यमान (ए आर) कितनी बार रासायनिक तत्व के परमाणुओं का औसत द्रव्यमान 1/12 से अधिक है कार्बन परमाणु का द्रव्यमान।
चूंकि कार्बन मुक्त राज्य में monatomic सी अणुओं के रूप में मौजूद है, इसके परमाणु और आणविक द्रव्यमान मूल्य मेल खाता है। वे 12.0064 हैं।
मुक्त राज्य में, कार्बन एक हीरे के रूप में मौजूद होता है, जो घन और हेक्सागोनल (लोन्सडलाइट) प्रणाली में क्रिस्टलाइज होता है, और ग्रेफाइट, जो हेक्सागोनल सिस्टम (चित्र 1) से संबंधित होता है। चारकोल, कोक या सूट जैसे कार्बन रूपों में एक विकृत संरचना होती है। एलोट्रॉपिक संशोधनों को भी सिंथेटिक रूप से प्राप्त किया जाता है - ये कार्बन और पॉलीक्यूमुलिन होते हैं - प्रकार-सी = सी- या = सी = सी = के रैखिक श्रृंखला बहुलकों से निर्मित कार्बन किस्मों।
अंजीर। 1. ऑलोट्रॉपिक कार्बन संशोधन।
कार्बन के एलोट्रॉपिक संशोधनों को भी जाना जाता है, जिनके निम्नलिखित नाम हैं: ग्रैफेन, फुलेरिन, नैनोट्यूब, नैनोफिबर्स, एस्ट्रेलन, कांच कार्बन, विशाल नैनोट्यूब; असंगत कार्बन, कार्बन नैनोट्यूब और कार्बन नैनोपेन।
प्रकृति में, कार्बन 12 सी (98.98%) और 13 सी (1.07%) के दो स्थिर आइसोटोप के रूप में मौजूद है। उनकी जन संख्या क्रमशः 12 और 13 है। कार्बन 12 सी आइसोटोप के नाभिक में छह प्रोटॉन और छह न्यूट्रॉन होते हैं, और 13 सी आइसोटोप में प्रोटॉन और पांच न्यूट्रॉन की संख्या होती है।
5730 वर्षों के आधे जीवन के साथ एक कृत्रिम (रेडियोधर्मी) कार्बन आइसोटोप 14 सीसी है।
कार्बन परमाणु के बाहरी ऊर्जा स्तर पर चार इलेक्ट्रॉन होते हैं जो वैलेंस होते हैं:
1 एस 2 2 एस 2 2 पी 2।
रासायनिक बातचीत के परिणामस्वरूप, कार्बन अपने वैलेंस इलेक्ट्रॉनों को खो सकता है, यानी। उनके दाता बनें, और सकारात्मक चार्ज आयनों में बदल दें या किसी अन्य परमाणु के इलेक्ट्रॉनों को स्वीकार करें, यानी। उनके स्वीकार्य बनें, और नकारात्मक चार्ज आयनों में बदल दें:
सी 0 -2e → सी 2+;
सी 0 -4e → सी 4+;
С 0 + 4e → С 4-।
मुक्त राज्य में, कार्बन monatomic सी अणुओं के रूप में मौजूद है। हम कुछ गुण प्रस्तुत करते हैं जो एक परमाणु और कार्बन अणु की विशेषता है:
दुनिया में सबसे प्रसिद्ध कार्बन मिश्र धातु इस्पात और कच्चे लोहे हैं। स्टील कार्बन के साथ लौह का मिश्र धातु है, जिसकी कार्बन सामग्री 2% से अधिक नहीं है। कास्ट आयरन (कार्बन के साथ लौह का मिश्र धातु भी) कार्बन सामग्री अधिक है - 2 से 4% तक।
उदाहरण 1
| कार्य | अशुद्धता के 0.1 द्रव्यमान युक्त युक्त चूना पत्थर के 500 ग्राम भुनाते समय कार्बन मोनोऑक्साइड (चतुर्थ) खड़ा होगा (एनयू)। |
| निर्णय | हम चूना पत्थर जलने की प्रतिक्रिया के समीकरण लिखते हैं: CaCO 3 = CaO + CO 2 -। शुद्ध चूना पत्थर का द्रव्यमान खोजें। ऐसा करने के लिए, पहले अशुद्धता के बिना अपने द्रव्यमान अंश निर्धारित करें: डब्ल्यू स्पष्ट (CaCO 3) = 1 - डब्ल्यू अशुद्धता = 1 - 0.1 = 0.9। एम स्पष्ट (CaCO 3) = एम (CaCO 3) × डब्ल्यू स्पष्ट (CaCO 3); एम स्पष्ट (CaCO 3) = 500 × 0.9 = 450 ग्राम चूना पत्थर पदार्थ की मात्रा की गणना करें: एन (CaCO 3) = एम स्पष्ट (CaCO 3) / एम (CaCO 3); एन (CaCO 3) = 450/100 = 4.5 मिलीग्राम। प्रतिक्रिया समीकरण एन (CaCO 3) के अनुसार: एन (सीओ 2) = 1: 1, इसका मतलब है एन (CaCO 3) = एन (सीओ 2) = 4.5 मिलीग्राम। फिर, जारी कार्बन मोनोऑक्साइड (IV) की मात्रा बराबर होगी: वी (सीओ 2) = एन (सीओ 2) × वी मीटर; वी (सीओ 2) = 4.5 × 22.4 = 100.8 एल। |
| जवाब | 100.8 एल |
उदाहरण 2
| कार्य | कैल्शियम कार्बोनेट के 11.2 ग्राम को बेअसर करने के लिए 0.05 द्रव्यमान अंश या 5% हाइड्रोजन क्लोराइड युक्त समाधान में कितना आवश्यकता होगी? |
| निर्णय | हम हाइड्रोजन क्लोराइड के साथ कैल्शियम कार्बोनेट के तटस्थ करने के लिए प्रतिक्रिया समीकरण लिखते हैं: CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 -। कैल्शियम कार्बोनेट पदार्थ की मात्रा पाएं: एम (काको 3) = आर (सीए) + आर (सी) + 3 × आर (ओ); एम (काको 3) = 40 + 12 + 3 × 16 = 52 + 48 = 100 ग्राम / एमओएल। एन (CaCO 3) = एम (CaCO 3) / एम (CaCO 3); एन (CaCO 3) = 11.2 / 100 = 0.112 एमओएल। प्रतिक्रिया एन (CaCO 3) के समीकरण के अनुसार: एन (एचसीएल) = 1: 2, इसका मतलब है एन (एचसीएल) = 2 × एन (CaCO 3) = 2 × 0.224 एमओएल। समाधान में निहित पदार्थ हाइड्रोजन क्लोराइड के द्रव्यमान का निर्धारण करें: एम (एचसीएल) = आर (एच) + आर (सीएल) = 1 + 35.5 = 36.5 जी / एमओएल। एम (एचसीएल) = एन (एचसीएल) × एम (एचसीएल) = 0.224 × 36.5 = 8.176 जी हाइड्रोजन क्लोराइड के समाधान के द्रव्यमान की गणना करें: एम समाधान (एचसीएल) = एम (एचसीएल) × 100 / डब्ल्यू (एचसीएल); एम समाधान (एचसीएल) = 8.176 × 100/5 = 163.52 ग्राम। |
| जवाब | 163.52 ग्राम |