Zariadenie, typy a schémy pripojovacích stmievačiek žiaroviek
Pri prevádzke štandardného spínača môžete dosiahnuť maximálny jas žiaroviek. Ale existujú situácie ...
C (karbón), nekovový chemický prvok skupiny IVA (C, Si, Ge, Sn, Pb) periodickej tabuľky prvkov. V prírode sa vyskytuje vo forme diamantových kryštálov (grafit alebo fullerén a iné formy) a je súčasťou organických (uhoľných, olejových, živočíšnych a rastlinných organizmov atď.) A anorganických látok (vápenec, sóda, atď.). Uhlík je rozšírený, ale jeho obsah v zemskej kôre je len 0,19% ( pozri tiež DIAMOND; Fullerény).
Uhlík sa široko používa vo forme jednoduchých látok. Okrem drahých diamantov, ktoré sú predmetom šperkov, majú priemyselné diamanty veľký význam? na výrobu brúsnych a rezacích nástrojov. Uhlie a iné amorfné formy uhlíka sa používajú na bielenie, čistenie, adsorpciu plynu v oblastiach technológie, ktoré vyžadujú adsorbenty s rozvinutým povrchom. Karbidy, zlúčeniny uhlíka s kovmi, ako aj bór a kremík (napríklad Al 4 C 3, SiC, B 4 C) sa vyznačujú vysokou tvrdosťou a používajú sa na výrobu brúsnych a rezných nástrojov. Uhlík je súčasťou ocele a zliatin v elementárnom stave a vo forme karbidov. Nasýtenie povrchu oceľových odliatkov uhlíkom pri vysokej teplote (cementácia) výrazne zvyšuje tvrdosť povrchu a odolnosť proti opotrebovaniu. Pozri tiež Zliatin.
V prírode existuje veľa rôznych foriem grafitu; niektoré sú umelo získané; existujú amorfné formy (napríklad koks a drevené uhlie). Sadze, kostí, lampové sadze, acetylénové sadze sa vytvárajú spaľovaním uhľovodíkov s nedostatkom kyslíka. Tzv biely uhlík sa získa sublimáciou pyrolytického grafitu pri zníženom tlaku? sú to najmenšie priehľadné kryštály grafitových listov so zaoblenými hranami.
Sunyaev Z.I. Olejový uhlík, M., 1980
Chémia má hyperkoordinovaný uhlík, M., 1990
Nájdite "CARBON" na adrese
4.1 Oxid uhoľnatý.
4.2 Kyselina uhličitá.
Uhlík je základom organických, bioorganických zlúčenín a mnohých polymérov.
Väčšina uhlíkových zlúčenín sú organické látky, ale v tejto práci budeme venovať pozornosť takzvaným anorganickým zlúčeninám uhlíka. Patria k nim - jednoduché látky (prírodný grafit, diamant a synteticky vyrobená karbinácia), oxidy uhlíka, kyselina uhličitá a množstvo solí tvorených kyselinou uhličitou.
Relatívna atómová hmotnosť uhlíka je 12,01, hustota (grafitu) je 2,27 g / cm3,
bod tavenia tpl = 3370 ° C (vyhorený), bod varu tbip = 4200 ° C.
2. Vlastnosti štruktúry atómov uhlíka.
Rozmanitosť a množstvo uhlíkových zlúčenín sa vysvetľuje štruktúrou jeho atómu. V atóme uhlíka v jeho vonkajších štyroch atómových orbitaloch sú štyri elektróny. A všetky štyri atómové orbitaly sa podieľajú na tvorbe chemických väzieb.
Obzvlášť grafit a diamant sú alotropické modifikácie s atómovými kryštálovými mriežkami, ktoré majú odlišnú štruktúru. Preto rozdiely vo fyzikálnych a chemických vlastnostiach.
V diamantu je každý atóm uhlíka naviazaný na štyri ďalšie atómy. Vo vesmíre sú tieto atómy umiestnené v strede a rohy štvorsteny spojené s ich vrcholmi. Je to veľmi symetrická a trvanlivá mriežka.
Diamond je známy ako najťažšia látka v prírode.
V grafite sú navzájom prepojené tri atómy, ležiace v tej istej rovine. Preto vznik týchto väzieb nastáva za účasti troch atómových orbitálov s tromi elektrónmi. Každý atóm je spojený s tromi inými ležiacimi v rovnakej rovine. Na vytvorenie týchto zväzkov sa vynakladajú tri AO s tromi elektrónmi. Štvrtý orbitál s jedným elektrónom je kolmý na rovinu. Tieto zostávajúce atómové orbitály celej siete sa navzájom prekrývajú a tvoria zónu molekulárnych orbitálov. Táto zóna je obsadená polovicou, ktorá poskytuje grafit, na rozdiel od diamantu, s dobrou kovovou vodivosťou.
3. Fyzikálne vlastnosti.
Tu je v prvom rade samozrejmé, že by sme si mali všimnúť vysokú pevnosť jednoduchých zlúčenín uhlíka.
Väzbová energia medzi atómami uhlíka v jednoduchých a komplexných látkach, vrátane diamantu a grafitu, je veľmi vysoká. Tvrdosť diamantu už bola povedaná. Silná väzba medzi atómami a grafitovou mriežkou.
Napríklad pevnosť v ťahu grafitového vlákna výrazne presahuje pevnosť železa a technickej ocele.
Refraktérnosť je ďalšou jedinečnou vlastnosťou grafitu, pretože Teplota topenia grafitu je vyššia ako 3500 ° C. V prírode je grafit najviac žiaruvzdorná jednoduchá látka.
Vysoká elektrická vodivosť grafitu je dôsledkom absencie akýchkoľvek interakčných produktov s prostredím na svojom povrchu, ako sú napríklad oxidy na kovoch.
Okrem toho grafit má schopnosť mať mazací účinok na trecie plochy. Vysvetľuje to skutočnosť, že atómy uhlíka v grafitovom kryštáliku sú pevne spojené v plochých sieťach a väzba medzi očkami je slabá a má intermolekulárny charakter (ako v látkach s molekulárnymi mriežkami). Výsledkom je, že už malé mechanické sily spôsobujú vzájomné premiestňovanie mriežok. To spôsobuje pôsobenie grafitu ako mazadla.
4. Chemické vlastnosti uhlíka a jeho zlúčenín.
Jednou z hlavných chemických vlastností uhlíka sú jeho silné redukčné vlastnosti. Iba pri relatívne nízkych teplotách je uhlík chemicky inertný.
Pozrime sa bližšie na chemické vlastnosti uhlíka:
Spaľovanie v kyslíku C + O2 = C02 + Q;
Interakcia s oxidom uhoľnatým С + СО2 = 2CO;
Redukcia kovov z oxidov 3С + Fe2O3 = 3CO2 + 4Fe.
4.1 Oxid uhoľnatý.
Oxid uhoľnatý je výsledkom úplného spaľovania uhlíka a látok, ktoré ho obsahujú.
V zlúčeninách s kyslíkom má uhlík v závislosti od podmienok valencie +2 a +4.
Keď teplota konvenčného plameňa počas spaľovania látok obsahujúcich uhlík (palivové drevo, uhlie, zemný plyn, metán, alkohol atď.), Reakcia prebieha:
C + O2 = C02
Ak sú na druhej strane vytvorené podmienky na zvýšenie teploty, napríklad je redukcia chladiča (v hustom stave horiaceho uhlia vrátane vysokej pece), potom reakcie prebiehajú:
C + 02 = 2CO
C02 + C = 2CO
Tvorí sa aj v týchto prípadoch:
Oxidácia biochemických procesov, dýchanie, rozpad,
Spálenie metánu
CH4 + 02 = C02 + 2H20
Interakcia kyselín s uhličitanmi
Tepelný rozklad uhličitanov a hydrogenuhličitanov:
CaCO3 = CaO + C02
2NaHCO3 = Na2C03 + C02 + H20
Oxid uhoľnatý je ťažší ako vzduch, ide o plyn bez zápachu, farbu a chuť.
1. Keď sa rozpustí, reaguje s vodou na vytvorenie kyseliny uhličitej:
CO 2 + H 2 O = H 2CO 3
2. Reaguje s hlavnými oxidmi:
CO 2 + CaO = CaC03
3. Reaguje s dôvodmi:
CO 2 + Ca (OH) 2 = CaC03 + H20
4.2 Kyselina uhličitá.
Slabá kyselina dvojsýtna, ktorá vzniká rozpustením oxidu uhoľnatého C02 vo vode.
Kyselina uhličitá poskytuje dva rady soli:
Vodorozpustné hydrogenuhličitany (hydrogenuhličitan sodný Na2CO3, uhličitan sodný, uhličitan draselný, draslík),
Nerozpustný (MgCO3, CaCO3).
Reakcie tvorby uhľovodíkov a uhličitanov:
CO 2 + NaOH = NaHC03
CO 2 + 2NaOH = Na2C03 + H20
Soli kyseliny uhličitej sa hydrolyzujú.
Kysličník uhličitý je vytesnený zo solí silnejšími kyselinami:
CaC03 + 2HCI = CaCl2 + C02 + H20
5. Používanie uhlíka a jeho zlúčenín.
V priemysle sa často používa ako mazivo uhlík (grafit).
Okrem toho sa na základe grafitu vytvárajú takzvané kompozitné materiály, najmä uhlíkové plasty, v ktorých sú grafitové vlákna umiestnené na matrici epoxidovej živice.
Odolnosť proti korózii grafitu sa používa pri stavbe lodí.
Tieto kompozitné materiály sú široko používané v leteckej a vesmírnej technológii. Koniec koncov, okrem sily, sú ľahké. Stačí porovnať hustotu grafitu, p = 2,3 g / cm3, s hustotou "ľahkého" hliníka, p = 2,7 g / cm3 a čím viac železa, p = 7,9 g / cm3, vlastnosti.
A samozrejme, všetci vieme, že diamanty sa používajú v šperkovom priemysle na výrobu všetkých druhov šperkov a sú tiež široko používané v rôznych odvetviach, kde sa používa ich vysoká pevnosť.
MOU "Secondary Secondary School Nikiforovskaya №1"
Uhlík a jeho hlavné anorganické zlúčeniny
abstraktné
Dokončené: študent 9V trieda
Sidorov Alexander
Učiteľ: Sakharova L.N.
Dmitrievka 2009
úvod
Kapitola I. Všetko o uhlíku
1.1. Uhlík v prírode
1.2. Alotropické modifikácie uhlíka
1.3. Chemické vlastnosti uhlíka
1.4. Použitie uhlíka
Kapitola II Anorganické zlúčeniny uhlíka
záver
literatúra
úvod
Carbon (lat. Carboneum) C je chemický prvok skupiny IV periodického systému: Atómové číslo 6, atómová hmotnosť 12,011 (1). Zvážte štruktúru uhlíkového atómu. Na vonkajšej energetickej úrovni atómu uhlíka sú štyri elektróny. Nakreslite graficky:
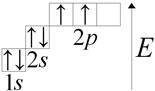
Uhol je známy už od dávnych čias a názov objaviteľa tohto prvku nie je známy.
Na konci XVII storočia. Florentinskí vedci Averani a Tardzhoni sa pokúsili zmiešať niekoľko malých diamantov do jedného veľkého a zahriať ich pomocou zapáleného skla slnečným svetlom. Diamanty zmizli, zapálili sa vo vzduchu. V roku 1772 francúzsky chemik A. Lavoisier ukázal, že CO 2 vzniká pri spaľovaní diamantu. Až v roku 1797 dokázal anglický vedec S. Tennant identitu charakteru grafitu a uhlia. Po spaľovaní rovnakého množstva uhlia a diamantu sa objemy oxidu uhoľnatého (IV) ukázali byť rovnaké.
Rozmanitosť uhlíkových zlúčenín, vzhľadom na schopnosť ich atómov navzájom sa kombinovať a atómy iných prvkov rôznymi spôsobmi, určuje špeciálnu polohu uhlíka medzi ostatnými prvkami.
hlava ja , Všetko o uhlíku
1.1. Uhlík v prírode
Uhlík sa nachádza v prírode, a to ako vo voľnom stave, tak aj vo forme zlúčenín.
Voľný uhlík sa nachádza vo forme diamantu, grafitu a karbynu.
Diamanty sú veľmi zriedkavé. Najväčší známy diamant, Cullinan, sa našiel v Južnej Afrike v roku 1905, vážil 621,2 g a meral 10 × 6,5 × 5 cm. Jeden z najväčších a najkrajších diamantov je uložený v diamantovom fonde v Moskve. svet - "Eagles" (37,92 g).
Diamant dostal svoje meno z gréčtiny. "Adamas" - neporaziteľný, nezničiteľný. Najvýznamnejšie diamantové ložiská sa nachádzajú v Južnej Afrike, Brazílii a Jakutsku.
Veľké ložiská grafitu sa nachádzajú v Nemecku, na Srí Lanke, na Sibíri v Altai.
Hlavné minerály obsahujúce uhlík sú: magnezit MgCO3, vápenec (vápenec, vápenec, mramor, krieda) CaCO 3, dolomit CaMg (CO 3) 2 atď.
Všetky horľavé minerály - ropa, plyn, rašelina, kameň a hnedé uhlie, bridlica - sú postavené na uhlíkovom základe. Niektoré fosílne uhlie s obsahom až 99% C sú zložené z uhlíka.
Uhlík predstavuje 0,1% zemskej kôry.
Vo forme oxidu uhoľnatého (IV) je uhlíkom C02 zložka atmosféry. Veľké množstvo CO 2 sa rozpustí v hydrosfére.
1.2. Alotropické modifikácie uhlíka
Elementálny uhlík tvorí tri alotropické modifikácie: diamant, grafit, karbín.
1. Diamant - bezfarebná, transparentná kryštalická látka, mimoriadne silno odrážajúca lúče svetla. Atómy uhlíka v diamante sú v stave sp3 hybridizácie. V excitovanom stave dochádza k odparovaniu valenčných elektrónov v uhlíkových atómoch a tvorbe štyroch nespálených elektrónov. Pri vytváraní chemických väzieb získajú elektrónové oblaky rovnaký predĺžený tvar a sú usporiadané v priestore tak, aby ich osi smerovali k vrcholom štvorstenca. Keď sa vrcholy týchto oblakov prekrývajú s oblakmi iných atómov uhlíka, vzniknú kovalentné väzby v uhle 109 ° 28 "a vytvára sa atómová kryštálová mriežka charakteristická pre diamant.
Každý atóm uhlíka v diamante je obklopený štyrmi inými, ktoré sú od neho umiestnené v smere od stredu štvorsteny po vrcholy. Vzdialenosť medzi atómami v tetrahedre je 0,154 nm. Sila všetkých väzieb je rovnaká. Takže atómy v diamante sú "veľmi" balené. Pri 20 ° C je hustota diamantu 3,515 g / cm3. To vysvetľuje jeho výnimočnú tvrdosť. Diamond nesprávne vedie elektrický prúd.
V roku 1961 začala sovietska únia priemyselná výroba syntetických diamantov z grafitu.
Pri priemyselnej syntéze diamantov sa používajú tlaky tisíce MPa a teploty od 1500 do 3000 ° C. Spôsob sa uskutočňuje v prítomnosti katalyzátorov, ktoré môžu slúžiť niektorým kovom, napríklad Ni. Prevažná časť diamantov tvoria malé kryštály a diamantový prach.
Pri zahrievaní bez prístupu vzduchu nad 1000 ° C sa diamant zmení na grafit. Pri 1750 ° C dochádza rýchlo k premene diamantu na grafit.

Diamantová štruktúra
2. Grafit je šedo-čierna kryštalická látka s kovovým leskom, mastnou na dotyk, nižšou tvrdosťou až po papier.
Atóm uhlíka v grafitových kryštáloch je v stave sp2 hybridizácie: každá z nich tvorí tri kovalentné väzby σ so susednými atómami. Úhly medzi smermi spojov sú 120 °. Výsledkom je mriežka vytvorená z bežných šesťuholníkov. Vzdialenosť medzi susednými jadrami atómov uhlíka vo vnútri vrstvy je 0,142 nm. Štvrtý elektrón vonkajšej vrstvy každého uhlíkového atómu v grafite je obsadený p-orbitálom, ktorý sa nezúčastňuje hybridizácie.
Nehybridné elektrónové oblaky atómov uhlíka sú orientované kolmo k rovine vrstvy a vzájomne sa prekrývajú, vytvárajú delokalizované σ-väzby. Priľahlé vrstvy v grafitovom kryštáliku sú od seba vzdialené 0,335 nm a slabo prepojené, hlavne silami van der Waalsových. Preto grafit má nízku mechanickú pevnosť a ľahko sa rozdelí na váhy, ktoré sú samy o sebe veľmi trvanlivé. Väzba medzi uhlíkovými vrstvami v grafite je čiastočne kovová. To vysvetľuje skutočnosť, že grafit vedie elektrinu dobre, ale stále nie je tak dobrý ako kovy.
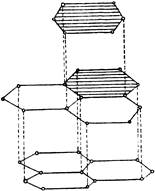
Grafitová štruktúra
Fyzikálne vlastnosti v grafite sa veľmi líšia v smeroch - kolmých a rovnobežných s vrstvami atómov uhlíka.
Keď sa zahrieva bez vzduchu, grafit nepodlieha žiadnym zmenám na 3700 ° C. Pri tejto teplote sa sublimuje, nie sa topí.
Umelý grafit sa získava z najlepších druhov uhlia pri 3000 ° C v elektrických peciach bez prístupu vzduchu.
Grafit je termodynamicky stabilný v širokom rozsahu teplôt a tlakov, a preto je akceptovaný ako štandardný stav uhlíka. Hustota grafitu je 2,265 g / cm3.
3. Carbin - jemnozrnný čierny prášok. Vo svojej kryštalickej štruktúre sú atómy uhlíka spojené v striedavých jednoduchých a trojitých väzbách v lineárnych reťazcoch:
-С = С - С≡С - С≡С-
Táto látka bola najskôr získaná V.V. Korshakom, A.M. Sladkov, V.I. Kasatochkin, Yu.P. Kudryavtsevym na začiatku 60. rokov XX. Storočia.
Následne sa ukázalo, že karbina môže existovať v rôznych formách a obsahuje ako polyacetylénové, tak aj polymérne reťazce, v ktorých sú atómy uhlíka spojené dvojitými väzbami:
C = C = C = C = C = C =
Karbín bol neskôr nájdený v prírode - v meteorickej látke.
Carbin má polovodičové vlastnosti, pod pôsobením svetla sa jeho vodivosť značne zvyšuje. V dôsledku existencie rôznych typov väzieb a rôznych spôsobov kladenia reťazcov atómov uhlíka v kryštálovej mriežke sa fyzikálne vlastnosti karbidu môžu značne líšiť. Pri zahrievaní bez prístupu vzduchu nad 2000 ° C je karbina stabilná, pri teplotách okolo 2300 ° C je pozorovaný jej prechod na grafit.
Prírodný uhlík pozostáva z dvoch izotopov
(98,892%) a (1,108%). Okrem toho sa v atmosfére nachádzajú nevýznamné nečistoty rádioaktívneho izotopu, ktorý sa vyrába umelým spôsobom.Predtým sa predpokladalo, že drevené uhlie, sadze a koks majú podobnú kompozíciu ako čistý uhlík a líšia sa vlastnosťami od diamantu a grafitu, predstavujú nezávislé alotropické modifikácie uhlíka ("amorfný uhlík"). Zistilo sa však, že tieto látky pozostávajú z najmenších kryštalických častíc, v ktorých sú atómy uhlíka viazané rovnakým spôsobom ako v grafite.
4. Uhlie - jemne mletý grafit. Vzniká pri tepelnom rozklade zlúčenín obsahujúcich uhlík bez prívodu vzduchu. Uhlie sa významne líšia v vlastnostiach v závislosti od látky, z ktorej boli získané a spôsobu výroby. Vždy obsahujú nečistoty, ktoré ovplyvňujú ich vlastnosti. Najdôležitejšie typy uhlia sú koks, drevené uhlie a sadze.
Koks sa získava zahrievaním uhlia bez prístupu vzduchu.
Uhlie sa vytvára, keď sa drevo zahrieva bez vzduchu.
Sadza je veľmi jemný grafitový kryštalický prášok. Vzniká spaľovaním uhľovodíkov (zemný plyn, acetylén, terpentín atď.) S obmedzeným prístupom vzduchu.
Aktívne uhlíky sú porézne priemyselné adsorbenty pozostávajúce predovšetkým z uhlíka. Adsorpcia sa týka absorpcie plynov a rozpustených látok na povrchu. Aktívne uhlíky sa získavajú z tuhých palív (rašelina, hnedé a čierne uhlie, antracit), drevo a jeho spracované produkty (drevené uhlie, piliny, odpad z papiera), odpad z kože, materiály živočíšneho pôvodu, ako sú kosti. Uhlie, ktoré sa vyznačujú vysokou mechanickou trvanlivosťou, sa vyrábajú z plášťa kokosového orecha a iných orechov z kôstkov ovocia. Štruktúra uhlia je reprezentovaná pórom všetkých veľkostí, avšak adsorpčná kapacita a rýchlosť adsorpcie sú určené obsahom mikropórov v jednotke hmotnosti alebo objemu granúl. Pri výrobe aktívneho uhlia sa počiatočný materiál najprv vystaví tepelnému spracovaniu bez vzduchu, v dôsledku čoho sa z neho odvádza vlhkosť a časť živice. To vytvára veľkú štruktúru pórov uhlia. Na získanie mikroporéznej štruktúry sa aktivácia uskutočňuje buď oxidáciou s plynom alebo parou, alebo reakciou s chemickými činidlami.
1.3. Chemické vlastnosti uhlíka
Pri bežných teplotách sú diamanty, grafity, uhlie chemicky inertné, ale pri vysokých teplotách sa ich aktivita zvyšuje. Ako vyplýva zo štruktúry hlavných foriem uhlíka, uhlie reaguje ľahšie než grafit a najmä diamant. Grafit je nielen reaktívnejší ako diamant, ale reakciou s určitými látkami môže tvoriť výrobky, ktoré diamant nevytvára.
1. Ako oxidačné činidlo reaguje uhlík s niektorými kovmi pri vysokých teplotách, čím vzniká karbid:
CS + 4Al = Al4C3 (karbid hliníka).
2. Vodík, uhlie a grafit tvoria uhľovodíky. Najjednoduchší zástupca - metán CH4 - sa môže získať v prítomnosti Ni katalyzátora pri vysokej teplote (600-1000 ° C):
CH 4.3. Pri interakcii s kyslíkom vykazuje uhlík znižujúce vlastnosti. Pri úplnom spaľovaní uhlíka akejkoľvek alotropickej modifikácie vzniká oxid uhoľnatý (IV):
C + O2 = C02.
Nekompletné spaľovanie vytvára oxid uhoľnatý (II) CO:
C + 02 = 2SO.
Obe reakcie sú exotermické.
4. Obzvlášť jasne sa redukujúce vlastnosti uhlia sa prejavujú pri interakcii s oxidmi kovov (zinok, meď, olovo atď.), Napríklad:
C + 2CuO = C02 + 2Cu,
C + 2ZnO = CO 2 + 2Zn.
Na týchto reakciách je založený najdôležitejší proces metalurgie - tavenie kovov z rúd.
V iných prípadoch, napríklad pri interakcii s oxidom vápenatým, sa vytvárajú karbidy:
CaO + ZS = CaC2 + CO.
5. Uhlie sa oxiduje horúcou koncentrovanou kyselinou sírovou a dusičnou:
C + 2H2S04 = C02 + 2S02 + 2H20,
3C + 4HN03 = 3C02 + 4NO + 2 H20.
Akákoľvek forma uhlíka odolná voči zásadám!
1.4. Použitie uhlíka
Diamanty sa používajú na spracovanie rôznych pevných materiálov, na rezanie, brúsenie, vŕtanie a gravírovanie skla, na vŕtanie skál. Po brúsení a rezaní sú diamanty premenené na diamanty, ktoré sa používajú ako šperky.
Grafit je najhodnotnejším materiálom pre moderný priemysel. Odliatky, taviace tégliky a iné žiaruvzdorné výrobky sú vyrobené z grafitu. Vďaka vysokej chemickej odolnosti sa grafit používa na výrobu rúr a prístrojov, ktoré sú z vnútornej strany lemované grafitovými platňami. Významné množstvo grafitu sa používa v elektrotechnickom priemysle, napríklad pri výrobe elektród. Grafit sa používa na výrobu ceruziek a niektorých náterov ako maziva. Veľmi čistý grafit sa používa v jadrových reaktoroch na spomalenie neutrónov.
Lineárny uhlíkový polymér - karbín - priťahuje pozornosť vedcov ako sľubného materiálu pre výrobu polovodičov, ktoré môžu pracovať pri vysokých teplotách a ultra silné vlákna.
Uhlie sa používa v metalurgickom priemysle, v kováčstve.
Koks sa používa ako redukčné činidlo pri tavení kovov z rúd.
Sadze sa používajú ako gumová náplň na zvýšenie pevnosti, takže pneumatiky pre automobily sú čierne. Sadze sa používajú ako súčasť tlačiarenských farieb, riasenky, leštiace prostriedky.
Aktívne uhlíky sa používajú na čistenie, extrakciu a oddeľovanie rôznych látok. Aktívne uhlíky sa používajú ako plnidlá na plynové masky a ako sorbent v medicíne.
hlava II , Anorganické zlúčeniny uhlíka
Uhlík tvorí dva oxidy - oxid uhoľnatý (CO) a oxid uhoľnatý (CO).
Oxid uhoľnatý (II) CO je bezfarebný plyn bez zápachu, zle rozpustný vo vode. Nazýva sa to oxid uhoľnatý, pretože je veľmi jedovatý. Pri vdychovaní do krvi sa rýchlo kombinuje s hemoglobínom, čím vytvára silnú zlúčeninu karboxyhemoglobínu, čím sa zbavuje hemoglobínu schopnosti prenášať kyslík.
Pri inhalácii vzduchu obsahujúceho 0,1% CO môže osoba náhle stratiť vedomie a zomrieť. Oxid uhoľnatý vzniká pri neúplnom spaľovaní paliva, čo je dôvod, prečo je nebezpečné predčasne uzavrieť komíny.
Oxid uhoľnatý (II) sa pripisuje, ako už viete, oxidom, ktorý nie je soľou, pretože ako nekovový oxid musí reagovať so zásadami a zásaditými oxidmi na vytvorenie soli a vody, čo však nie je pozorované.
2CO + 02 = 2CO2.
Oxid uhoľnatý (II) je schopný odoberať kyslík z oxidov kovov, t.j. na regeneráciu kovov z ich oxidov.
Fe2O3 + SOA = 2Fe + SOA 2.
Je to vlastnosť oxidu uhoľnatého (II) používaného v metalurgii pri tavení železa.
Oxid uhoľnatý (IV) C02 - bežne známy ako oxid uhličitý - je bezfarebný plyn bez zápachu. Je to asi jeden a pol násobne ťažší ako vzduch. Za normálnych podmienok sa jeden objem oxidu uhličitého rozpustí v 1 objeme vody.
Pri tlaku asi 60 atm sa oxid uhličitý zmení na bezfarebnú kvapalinu. Keď sa kvapalný oxid uhličitý odparí, časť z neho sa mení na pevnú snehovú hmotu, ktorá je v priemysle komprimovaná, to je "suchý ľad", ktorý je známy, ktorý sa používa na skladovanie potravinárskych výrobkov. Už viete, že tuhý oxid uhličitý má molekulárnu mriežku schopnú sublimácie.
Oxid uhličitý CO 2 je typický oxid kyseliny: reaguje s alkalickými látkami (napríklad spôsobuje zakalenie vápennej vody) so zásaditými oxidmi a vodou.
Nehorí a neudržiava spaľovanie, a preto sa používa na hasenie požiarov. Horčík však stále spaľuje oxid uhličitý, aby vytvoril oxid a uvoľnil uhlík vo forme sadzí.
C02 + 2Mg = 2MgO + C.
Oxid uhličitý sa získava pôsobením na soli kyseliny uhličitej - uhličitany roztokmi kyseliny chlorovodíkovej, dusičnej a dokonca aj kyseliny octovej. V laboratóriu sa oxid uhličitý vytvára pôsobením kyseliny chlorovodíkovej na kriedu alebo mramoru.
CaCO3 + 2HCl = CaCl2 + H20 + C02.
V priemysle sa oxid uhličitý získava spaľovaním vápenca:
CaCO3 = CaO + C2.
Oxid uhličitý sa okrem už uvedenej aplikácie používa aj na výrobu šumivých nápojov a na výrobu sódy.
Keď sa oxid uhličitý rozpustí vo vode, vytvára sa kyselina uhličitá H 2 CO 3, ktorá je veľmi nestabilná a ľahko sa rozkladá na jej počiatočné zložky - oxid uhličitý a vodu.
Ako kyselina dvojsýtna vytvára kyselina uhličitá dva rady solí: stredné uhličitany, ako je CaC03 a kyslé hydrogenuhličitany, ako je Ca (HCO3) 2. Z uhličitanov vo vode sú rozpustné len soli draslíka, sodíka a amoniaku. Kyslé soli sú všeobecne rozpustné vo vode.
Pri prebytku oxidu uhličitého v prítomnosti vody môžu byť uhličitany konvertované na hydrogenuhličitany. Ak sa teda oxid uhličitý prepadne vápennou vodou, najskôr sa kvôli vysrážanému vo vode nerozpustnému uhličitanu vápenatému zakalí, ale pri ďalšom prenose oxidu uhličitého zmizne oblačnosť v dôsledku tvorby rozpustného hydrogenuhličitanu vápenatého:
CACO 3 + H 2O + CO 2 = Ca (HCO 3) 2.
Práve prítomnosť tejto soli vysvetľuje dočasnú tvrdosť vody. Prečo dočasné? Keď sa zohreje, rozpustný hydrogenuhličitan vápenatý sa znova prevedie na nerozpustný uhličitan:
Ca (HCO3) 2 = CaC03 + H20 + Co2.
Táto reakcia vedie k vytvoreniu stupnice na stenách kotlov, parných vykurovacích potrubí a domácich kotlov a v prírode v dôsledku tejto reakcie visí podivné stalaktity visiace z jaskýň, smerom k ktorým stúpajú stalagmity zospodu.
Iné vápenaté a horečnaté soli, najmä chloridy a sírany, poskytujú vodu konštantnú tuhosť. Varená trvalá tvrdosť vody nemožno odstrániť. Musíme použiť iný uhličitan sodný.
Na2C03, ktorý konvertuje tieto Ca2 + ióny na sediment, napríklad:
L2 + Na2C03 = CaC03 + 2NaCl.
Soda môže byť tiež použitá na odstránenie dočasnej tvrdosti vody.
Uhličitany a hydrogenuhličitany sa môžu detegovať pomocou kyslých roztokov: pri pôsobení kyselín sa pozoruje charakteristický "vrieť" v dôsledku uvoľňovaného oxidu uhličitého.
Táto reakcia je kvalitatívnou reakciou na soli kyseliny uhličitej.
záver
Všetka smrteľná životnosť je založená na uhlíku. Každá molekula živého organizmu je postavená na základe uhlíkového skeletu. Atómy uhlíka neustále migrujú z jednej časti biosféry (úzkeho plášťa Zeme, kde život existuje) druhému. Použitím uhlíkového cyklu v prírode ako príkladu môžeme sledovať obraz života na našej planéte v dynamike.
Hlavné uhlíkové zásoby na Zemi sú vo forme oxidu uhličitého v atmosfére a rozpustené v oceánoch, to znamená oxidu uhličitého (CO 2). Najskôr zvážte molekuly oxidu uhličitého v atmosfére. Rastliny absorbujú tieto molekuly, potom sa v procese fotosyntézy uhlíkový atóm premení na rôzne organické zlúčeniny a tak sa začlení do štruktúry rastlín. Ďalej existuje niekoľko možností:
1. Uhoľ môže zostať v rastlinách, kým rastliny zomrú. Potom sa ich molekuly dostanú do potravy k rozkladačom (organizmom, ktoré sa živia mŕtvou organickou hmotou a súčasne ju zničia jednoduchými anorganickými zlúčeninami), ako sú huby a termity. Nakoniec sa uhlík vráti do atmosféry ako CO 2;
2. Rastliny môžu byť konzumované bylinožravcami. V tomto prípade sa uhlík buď vráti do atmosféry (v procese dýchania zvierat a keď sa rozloží po smrti), alebo by býložravé zvieratá konzumujú mäsožravce (a potom sa uhlík opäť vráti do atmosféry rovnakým spôsobom);
3. rastliny môžu zomrieť a skončiť pod zemou. Potom sa nakoniec premení na fosílne palivá - napríklad uhlie.
V prípade rozpustenia pôvodnej molekuly CO 2 v morskej vode je možné aj niekoľko možností:
Oxid uhličitý sa môže jednoducho vrátiť do atmosféry (tento druh vzájomnej výmeny plynu medzi oceánmi a atmosférou sa stáva neustále);
Uhlík môže vstúpiť do tkanív morských rastlín alebo zvierat. Potom sa bude postupne hromadiť vo forme sedimentov na dne oceánov a nakoniec sa zmení na vápenec alebo z usadenín sa opäť zmení na morskú vodu.
Ak je uhlík súčasťou sedimentu alebo fosílnych palív, odstraňuje sa z atmosféry. Počas existencie Zeme bol takto odstránený uhlík nahradený oxidom uhličitým, ktorý sa dostal do atmosféry počas vulkanických erupcií a iných geotermálnych procesov. V moderných podmienkach sa do týchto prírodných faktorov pridávajú aj emisie z ľudských fosílnych palív. Vzhľadom na vplyv CO 2 na skleníkový efekt sa štúdium uhlíkového cyklu stalo dôležitou úlohou pre vedcov, ktorí skúmajú atmosféru.
Súčasťou tohto vyhľadávania je určenie množstva CO 2, ktoré sa nachádza v rastlinných tkanivách (napríklad v novo vysadenom lese) - vedci nazývajú uhlie. Keďže vlády rôznych krajín sa snažia dosiahnuť medzinárodnú dohodu o obmedzení emisií CO 2, otázka vyváženého pomeru záchvatov a emisií uhlíka v jednotlivých štátoch sa stala hlavnou kosťou konfliktu pre priemyselné krajiny. Vedci však pochybujú, že akumulácia oxidu uhličitého v atmosfére môže byť zastavená len plantážami.
Uhlíka neustále cirkuluje v suchozemskej biosfére prostredníctvom uzavretých vzájomne prepojených ciest. V súčasnosti sa účinky prirodzených procesov pridávajú do spaľovania fosílnych palív.
Referencie:
1. Akhmetov N.S. Chémia 9. ročník: štúdie. pre všeobecné vzdelávanie. Proc. inštitúcie. - 2. vyd. - M .: Vzdelávanie, 1999. - 175 p .: Il.
2. Gabrielyan O.S. Chémia 9. ročník: štúdie. pre všeobecné vzdelávanie. Proc. inštitúcie. - 4. vyd. - M .: Drofa, 2001. - 224 s., Ill.
3. Gabrielyan O.S. Chémia stupňa 8-9: metóda. Príspevok. - 4. vyd. - M .: Drofa, 2001. - 128 s.
4. Eroshin D.P., Shishkin E.A. Metódy riešenia problémov v chémii: štúdie. Príspevok. - M .: Enlightenment, 1989. - 176 s., Ill.
5. Kremenchug M. Chémia: Príručka študenta. - M .: Filol. Spoločnosť "WORD": Izd-vo AST, LLC, 2001. - 478 s.
6. Kritsman V.A. Kniha čítať anorganickú chémiu. - M .: Enlightenment, 1986. - 273 str.