Výpočet výkonu pre prúd a napätie
Ako viete, elektrické napätie by malo mať svoje vlastné opatrenie, ktoré na začiatku zodpovedá hodnote, ktorá ...
C (karbón), nekovový chemický prvok skupiny IVA (C, Si, Ge, Sn, Pb) periodickej tabuľky prvkov. V prírode sa nachádza vo forme diamantových kryštálov (grafit alebo fullerén a iné formy) a je súčasťou organických (uhoľných, olejových, živočíšnych a rastlinných organizmov atď.) A anorganických látok (vápenec, sóda na pečenie atď.). Uhlík je rozšírený, ale jeho obsah v zemskej kôre je len 0,19% ( pozri tiež DIAMOND; Fullerény).
Uhlík sa široko používa vo forme jednoduchých látok. Okrem drahocenných diamantov, ktoré sú predmetom šperkov, majú priemyselné diamanty veľký význam? na výrobu brúsnych a rezacích nástrojov. Uhlie a iné amorfné formy uhlíka sa používajú na bielenie, čistenie, adsorpciu plynu v oblastiach technológie, kde sú potrebné adsorbenty s rozvinutým povrchom. Karbidy, zlúčeniny uhlíka s kovmi, ako aj bór a kremík (napríklad Al4C3, SiC, B4C) sa vyznačujú vysokou tvrdosťou a používajú sa na výrobu brúsnych a rezných nástrojov. Uhlík je súčasťou ocele a zliatin v elementárnom stave a vo forme karbidov. Nasýtenie povrchu oceľových odliatkov s uhlíkom pri vysokej teplote (cementácia) výrazne zvyšuje tvrdosť povrchu a odolnosť proti opotrebovaniu. Pozri tiež Zliatin.
V prírode existuje veľa rôznych foriem grafitu; niektoré sú umelo získané; existujú amorfné formy (napríklad koks a drevené uhlie). Sadze, kyslé drevené uhlie, sadze, acetylénové sadze sa vytvárajú spaľovaním uhľovodíkov s nedostatkom kyslíka. Tzv biely uhlík sa získa sublimáciou pyrolytického grafitu pri zníženom tlaku? to sú najmenšie priehľadné kryštály grafitových listov so špicatými okrajmi.
Sunyaev Z.I. Olejový uhlík, M., 1980
Chémia má hyperkoordinovaný uhlík, M., 1990
Vyhľadajte "CARBON" na
4.1 Oxid uhoľnatý.
4.2 Kyselina uhličitá.
Uhlík je základom organických, bioorganických zlúčenín a mnohých polymérov.
Väčšina uhlíkových zlúčenín sú organické látky, ale v tejto práci budeme venovať pozornosť takzvaným anorganickým zlúčeninám uhlíka. Patria k nim - jednoduché látky (prírodný grafit, diamant a synteticky získaná karbinácia), oxidy uhlíka, kyselina uhličitá a množstvo solí tvorených kyselinou uhličitou.
Relatívna atómová hmotnosť uhlíka je 12,01, hustota (grafitu) je 2,27 g / cm3,
bod topenia tpl = 3370 ° C (vyhorený), bod varu tbip = 4200 ° C.
2. Vlastnosti štruktúry atómov uhlíka.
Rozmanitosť a množstvo uhlíkových zlúčenín sa vysvetľuje štruktúrou jeho atómu. V atóme uhlíka v jeho vonkajších štyroch atómových orbitaloch sú štyri elektróny. A všetky štyri atómové orbitaly sa podieľajú na tvorbe chemických väzieb.
Obzvlášť grafit a diamant sú alotropické modifikácie s atómovými kryštálovými mriežkami, ktoré majú odlišnú štruktúru. Preto rozdiely vo fyzikálnych a chemických vlastnostiach.
V diamante je každý atóm uhlíka naviazaný na štyri ďalšie atómy. Vo vesmíre sú tieto atómy umiestnené v strede a rohy štvorsteny spojené s ich vrcholmi. Ide o veľmi symetrickú a trvanlivú mriežku.
Diamond je známy ako najťažšia látka v prírode.
V grafite sú navzájom prepojené tri atómy, ležiace v tej istej rovine. Preto tvorba týchto väzieb nastáva za účasti troch atómových orbitálov s tromi elektrónmi. Každý atóm je spojený s troma inými ležiacimi v rovnakej rovine. Na vytvorenie týchto väzieb sa vynakladajú tri AO s tromi elektrónmi. Štvrtý orbitál s jedným elektrónom je kolmý na rovinu. Tieto zostávajúce atómové dráhy celej mriežky sa navzájom prekrývajú a tvoria zónu molekulárnych orbitalov. Táto zóna je obsadená polovicou, ktorá poskytuje grafit, na rozdiel od diamantu, s dobrou kovovou vodivosťou.
3. Fyzikálne vlastnosti.
Tu je, samozrejme, samozrejmé, že by sme si mali všimnúť vysokú pevnosť jednoduchých zlúčenín uhlíka.
Väzbová energia medzi atómami uhlíka v jednoduchých a komplexných látkach, vrátane diamantu a grafitu, je veľmi vysoká. Tvrdosť diamantu už bola povedaná. Silná väzba medzi atómami a grafitovou mriežkou.
Napríklad pevnosť v ťahu grafitového vlákna výrazne presahuje pevnosť železa a technickej ocele.
Refraktérnosť je ďalšou jedinečnou vlastnosťou grafitu Teplota topenia grafitu je vyššia ako 3500 ° C. V grafe je najviac odolná jednoduchá látka.
Vysoká elektrická vodivosť grafitu je dôsledkom absencie akýchkoľvek interakčných produktov s prostredím na svojom povrchu, ako sú napríklad oxidy kovov.
Okrem toho grafit má schopnosť mať mazací účinok na trecie plochy. To je vysvetlené skutočnosťou, že uhlíkové atómy v grafitovom kryštáliku sú pevne spojené v plochých sieťach a väzba medzi očkami je slabá a má intermolekulárny charakter (ako v látkach s molekulárnymi mriežkami). Výsledkom toho je, že už malé mechanické sily spôsobujú vzájomné premiestňovanie mriežok. To spôsobuje pôsobenie grafitu ako lubrikantu.
4. Chemické vlastnosti uhlíka a jeho zlúčenín.
Jednou z hlavných chemických vlastností uhlíka sú jeho silné redukčné vlastnosti. Iba pri relatívne nízkych teplotách je uhlík chemicky inertný.
Pozrime sa podrobnejšie na chemické vlastnosti uhlíka:
Spaľovanie v kyslíku C + O2 = C02 + Q;
Interakcia s oxidom uhoľnatým С + СО2 = 2СО;
Redukcia kovov z oxidov 3С + Fe2O3 = 3CO2 + 4Fe.
4.1 Oxid uhoľnatý.
Oxid uhoľnatý je výsledkom úplného spaľovania uhlíka a látok, ktoré ho obsahujú.
V zlúčeninách s kyslíkom má uhlík v závislosti od podmienok valencie +2 a +4.
Keď teplota bežného plameňa počas spaľovania látok obsahujúcich uhlík (palivové drevo, uhlie, zemný plyn, metán, alkohol atď.), Reakcia prebieha:
C + O2 = C02
Ak sú na druhej strane vytvorené podmienky na zvýšenie teploty, napríklad dochádza k zníženiu chladiča (vnútri hrubšej vrstvy horiaceho uhlia vrátane vysokej pece), potom reakcie prebiehajú:
C + 02 = 2CO
C02 + C = 2CO
Tvorí sa tiež v týchto prípadoch:
Oxidácia biochemických procesov, dýchanie, rozpad,
Spálenie metánu
CH4 + 02 = C02 + 2H20
Interakcia kyselín s uhličitanmi
Tepelný rozklad uhličitanov a hydrogenuhličitanov:
CaCO3 = CaO + C02
2 NaHCO3 = Na2C03 + C02 + H20
Oxid uhoľnatý je ťažší ako vzduch, ide o plyn bez zápachu, farbu a chuť.
1. Po rozpustení reaguje s vodou za vzniku kyseliny uhličitej:
CO 2 + H 2 O = H 2CO 3
2. Reaguje s hlavnými oxidmi:
CO 2 + CaO = CaC03
3. Reaguje s dôvodmi:
CO 2 + Ca (OH) 2 = CaC03 + H20
4.2 Kyselina uhličitá.
Slabá kyselina dvojsýtna, ktorá vzniká pri rozpustení oxidu uhoľnatého CO 2 vo vode.
Kyselina uhličitá poskytuje dva rady soli:
Vodorozpustné hydrogenuhličitany (hydrogenuhličitan sodný, uhličitan sodný, uhličitan draselný, uhličitan draselný),
Nerozpustný (MgCO3, CaCO3).
Reakcie tvorby uhľovodíkov a uhličitanov:
CO 2 + NaOH = NaHC03
CO 2 + 2NaOH = Na2C03 + H20
Soli kyseliny uhličitej sa hydrolyzujú.
Kysličník uhličitý je vytesnený zo solí silnejšími kyselinami:
CaC03 + 2HCI = CaCl2 + C02 + H20
5. Používanie uhlíka a jeho zlúčenín.
V priemysle sa často používa ako mazivo uhlík (grafit).
Okrem toho sa na základe grafitu vytvárajú takzvané kompozitné materiály, najmä uhlíkové plasty, v ktorých sú grafitové vlákna umiestnené na matrici z epoxidovej živice.
Odolnosť voči korózii grafitu sa používa pri stavbe lodí.
Tieto kompozitné materiály sú široko používané v leteckej a vesmírnej technológii. Koniec koncov, okrem sily sú ľahké. Stačí porovnať hustotu grafitu, p = 2,3 g / cm3, s hustotou "ľahkého" hliníka, p = 2,7 g / cm3 a čím viac železa, p = 7,9 g / cm3, vlastnosti.
A samozrejme, všetci vieme, že diamanty sa používajú v šperkovom priemysle na výrobu všetkých druhov šperkov a sú tiež široko používané v rôznych odvetviach, kde sa používa ich vysoká pevnosť.
MOU "Secondary Secondary School Nikiforovskaya №1"
Uhlík a jeho hlavné anorganické zlúčeniny
abstraktné
Dokončené: študent 9V trieda
Sidorov Alexander
Učiteľ: Sakharova L.N.
Dmitrievka 2009
úvod
Kapitola I. Všetko o uhlíku
1.1. Uhlík v prírode
1.2. Alotropické modifikácie uhlíka
1.3. Chemické vlastnosti uhlíka
1.4. Použitie uhlíka
Kapitola II Anorganické zlúčeniny uhlíka
záver
literatúra
úvod
Carbon (lat. Carboneum) C je chemický prvok skupiny IV periodického systému: Atómové číslo 6, atómová hmotnosť 12,011 (1). Zvážte štruktúru uhlíkového atómu. Na vonkajšej energetickej úrovni atómu uhlíka sú štyri elektróny. Nakresliť graficky:
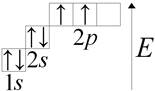
Uhol je známy už od dávnych čias a názov objaviteľa tohto prvku nie je známy.
Na konci XVII storočia. Florentinskí vedci Averani a Tardzhoni sa pokúsili zmiešať niekoľko malých diamantov do jedného veľkého a zahriať ich pomocou zapáleného skla slnečným svetlom. Diamanty zmizli, zapálili sa vo vzduchu. V roku 1772 francúzsky chemik A. Lavoisier ukázal, že CO 2 vzniká pri spaľovaní diamantu. Iba v roku 1797 dokázal anglický vedec S. Tennant identitu charakteru grafitu a uhlia. Po spaľovaní rovnakého množstva uhlia a diamantu sa objemy oxidu uhoľnatého (IV) ukázali byť rovnaké.
Rozmanitosť uhlíkových zlúčenín, vzhľadom na schopnosť ich atómov kombinovať navzájom a atómy iných prvkov rôznymi spôsobmi, určuje špeciálnu pozíciu uhlíka medzi ostatnými prvkami.
hlava ja , Všetko o uhlíku
1.1. Uhlík v prírode
Uhlík sa nachádza v prírode, a to ako vo voľnom stave, tak aj vo forme zlúčenín.
Voľný uhlík sa nachádza vo forme diamantu, grafitu a karbynu.
Diamanty sú veľmi zriedkavé. Najväčší známy diamant, Cullinan, sa našiel v Južnej Afrike v roku 1905, vážil 621,2 g a meral 10 × 6,5 × 5 cm. Jeden z najväčších a najkrajších diamantov v moskovskom diamantovom fonde svet - "Eagles" (37,92 g).
Diamant dostal svoje meno z gréčtiny. "Adamas" - neporaziteľný, nezničiteľný. Najvýznamnejšie diamantové ložiská sa nachádzajú v Južnej Afrike, Brazílii a Jakutsku.
Veľké ložiská grafitu sa nachádzajú v Nemecku, na Srí Lanke, na Sibíri, v Altai.
Medzi hlavné minerály obsahujúce uhlík patria: magnezit MgCO3, vápnik (vápenec, vápenec, mramor, krieda) CaCO 3, dolomit CaMg (CO 3) 2 atď.
Všetky horľavé minerály - ropa, plyn, rašelina, kameň a hnedé uhlie, bridlica - sú postavené na uhlíkovej báze. Niektoré fosílne uhlie obsahujúce až do 99% C sú v zložení blízko k uhlíku.
Uhlíka predstavuje 0,1% zemskej kôry.
Vo forme oxidu uhoľnatého (IV) je uhlíkom C02 zložka atmosféry. Veľké množstvo CO 2 sa rozpustí v hydrosfére.
1.2. Alotropické modifikácie uhlíka
Elementálny uhlík tvorí tri alotropické modifikácie: diamant, grafit, karbín.
1. Diamant - bezfarebná, transparentná kryštalická látka, mimoriadne silne lámajúca lúče svetla. Atóm uhlíka v diamante je v stave sp3 hybridizácie. V excitovanom stave dochádza k odparovaniu valenčných elektrónov v uhlíkových atómoch a tvorbe štyroch nepálených elektrónov. Pri vytváraní chemických väzieb získajú elektrónové oblaky rovnaký predĺžený tvar a sú usporiadané v priestore tak, aby ich osi smerovali k vrcholom štvorstenca. Keď sa vrcholy týchto oblakov prekrývajú s mrakmi iných atómov uhlíka, vzniknú kovalentné väzby pod uhlom 109 ° 28 "a vytvorí sa atómová kryštalická mriežka charakteristická pre diamant.
Každý atóm uhlíka v diamante je obklopený štyrmi ďalšími, ktoré sa nachádzajú odtiaľ v smere od stredu štvorsteny po vrcholy. Vzdialenosť medzi atómami v tetrahedre je 0,154 nm. Sila všetkých väzieb je rovnaká. Takže atómy v diamantu sú "veľmi balené". Pri 20 ° C je hustota diamantu 3,515 g / cm3. To vysvetľuje jeho výnimočnú tvrdosť. Diamond nesprávne vedie elektrický prúd.
V roku 1961 začala sovietska únia priemyselná výroba syntetických diamantov z grafitu.
Pri priemyselnej syntéze diamantov sa použil tlak v tisícoch MPa a teploty od 1500 do 3000 ° C. Spôsob sa uskutočňuje v prítomnosti katalyzátorov, ktoré môžu slúžiť niektorým kovom, napríklad Ni. Prevažná časť diamantov tvoria malé kryštály a diamantový prach.
Pri zahrievaní bez prístupu vzduchu nad 1000 ° C sa diamant zmení na grafit. Pri 1750 ° C dochádza rýchlo k premene diamantu na grafit.
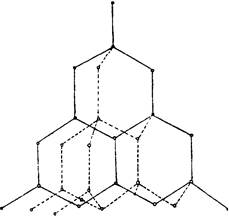
Diamantová štruktúra
2. Grafit je šedo-čierna kryštalická látka s kovovým leskom, mastnou na dotyk, nižšou tvrdosťou až po papier.
Atómy uhlíka v grafitových kryštáloch sú v stave sp2 hybridizácie: každá z nich tvorí tri kovalentné väzby σ so susednými atómami. Uhol medzi smermi väzby je 120 °. Výsledkom je mriežka vytvorená z bežných šesťuholníkov. Vzdialenosť medzi susednými jadrami atómov uhlíka vo vnútri vrstvy je 0,142 nm. Štvrtý elektrón vonkajšej vrstvy každého uhlíkového atómu v grafite je obsadený p-orbitálom, ktorý sa nezúčastňuje hybridizácie.
Nehybridné elektrónové oblaky atómov uhlíka sú orientované kolmo na rovinu vrstvy a vzájomne sa prekrývajú, vytvárajú delokalizované σ-väzby. Susedné vrstvy v grafitovom kryštáliku sú od seba vzdialené 0,335 nm a slabo prepojené, hlavne sílami van der Waalsovými. Preto grafit má nízku mechanickú pevnosť a ľahko sa rozdelí na váhy, ktoré sú samy o sebe veľmi trvanlivé. Väzba medzi uhlíkovými vrstvami v grafite je čiastočne kovová. To vysvetľuje skutočnosť, že grafit vedie elektrinu dobre, ale stále nie je tak dobrý ako kovy.

Grafitová štruktúra
Fyzikálne vlastnosti v grafite sa veľmi líšia v smeroch - kolmých a rovnobežných s vrstvami atómov uhlíka.
Pri zahrievaní bez vzduchu, grafit nepodlieha žiadnym zmenám až do 3700 ° C. Pri tejto teplote sa sublimuje, nie sa topí.
Umelý grafit sa získava z najlepších druhov uhlia pri 3000 ° C v elektrických peciach bez prístupu vzduchu.
Grafit je termodynamicky stabilný v širokom rozsahu teplôt a tlakov, a preto je akceptovaný ako štandardný stav uhlíka. Hustota grafitu je 2,265 g / cm3.
3. Carbin - jemnozrnný čierny prášok. Vo svojej kryštalickej štruktúre sú atómy uhlíka spojené v striedavých jednoduchých a trojitých väzbách v lineárnych reťazcoch:
-С = С - С≡С - С≡С-
Táto látka bola najskôr získaná V.V. Korshakom, A.M. Sladkov, V.I. Kasatochkin, Yu.P. Kudryavtsevym na začiatku 60. rokov XX. Storočia.
Následne sa ukázalo, že karbín môže existovať v rôznych formách a obsahuje ako polyacetylénové, tak aj polymérne reťazce, v ktorých sú atómy uhlíka spojené dvojitými väzbami:
C = C = C = C = C = C =
Karbín bol neskôr nájdený v prírode - v meteorickej látke.
Carbin má polovodičové vlastnosti, pod pôsobením svetla sa jeho vodivosť značne zvyšuje. Kvôli existencii rôznych typov väzieb a rôznych spôsobov kladenia reťazcov atómov uhlíka v kryštálovej mriežke sa fyzikálne vlastnosti karbynu môžu veľmi líšiť. Pri zahrievaní bez prístupu vzduchu nad 2000 ° C je karbina stabilná, pri teplotách okolo 2300 ° C je pozorovaný jej prechod na grafit.
Prírodný uhlík pozostáva z dvoch izotopov
(98,892%) a (1,108%). Okrem toho sa v atmosfére nachádzajú nevýznamné nečistoty rádioaktívneho izotopu, ktoré sa získavajú umelými prostriedkami.Predtým sa predpokladalo, že drevené uhlie, sadze a koks sú podobné zloženiu ako čistý uhlík a líšia sa vlastnosťami od diamantu a grafitu, predstavujú nezávislé alotropické modifikácie uhlíka ("amorfný uhlík"). Zistilo sa však, že tieto látky pozostávajú z najmenších kryštalických častíc, v ktorých sú atómy uhlíka viazané rovnakým spôsobom ako v grafite.
4. Uhlie - jemne mletý grafit. Vzniká pri tepelnom rozklade zlúčenín obsahujúcich uhlík bez prístupu vzduchu. Uhlie sa výrazne líšia vo vlastnostiach v závislosti od látky, z ktorej sú získané a spôsobu výroby. Vždy obsahujú nečistoty, ktoré ovplyvňujú ich vlastnosti. Najdôležitejšími typmi uhlia sú koks, uhlie a sadze.
Koks sa získava zahrievaním uhlia bez prístupu vzduchu.
Uhlie sa vytvára, keď sa drevo zahrieva bez vzduchu.
Sadza je veľmi jemný grafitový kryštalický prášok. Vzniká spaľovaním uhľovodíkov (zemný plyn, acetylén, terpentín atď.) S obmedzeným prístupom vzduchu.
Aktívne uhlíky sú porézne priemyselné adsorbenty pozostávajúce predovšetkým z uhlíka. Adsorpcia sa vzťahuje na absorpciu plynov a rozpustených látok na povrchu. Aktívne uhlíky sa získavajú z tuhých palív (rašelina, hnedé a čierne uhlie, antracit), dreva a jeho produktov (drevené uhlie, piliny, odpad z papiera), odpad z kože, materiály živočíšneho pôvodu, ako sú kosti. Uhlie, ktoré sa vyznačujú vysokou mechanickou trvanlivosťou, sa vyrábajú z plášťa kokosového orecha a iných orechov z kôstkov ovocia. Štruktúra uhlia je reprezentovaná pórom všetkých veľkostí, avšak adsorpčná kapacita a rýchlosť adsorpcie sú určené obsahom mikropórov na jednotku hmotnosti alebo objemu granúl. Pri výrobe aktívneho uhlia sa počiatočný materiál najprv podrobí tepelnému spracovaniu bez vzduchu, v dôsledku čoho sa z neho odstráni vlhkosť a časť živice. To vytvára veľkú štruktúru pórov uhlia. Na získanie mikroporéznej štruktúry sa aktivácia uskutočňuje buď oxidáciou plynom alebo parou, alebo reakciou s chemickými činidlami.
1.3. Chemické vlastnosti uhlíka
Pri bežných teplotách sú diamanty, grafity a uhlie chemicky inertné, ale pri vysokých teplotách sa ich aktivita zvyšuje. Ako vyplýva zo štruktúry hlavných foriem uhlíka, uhlie reaguje ľahšie než grafit a najmä diamant. Grafit je nielen reaktívnejší ako diamant, ale reakciou s určitými látkami môže tvoriť výrobky, ktoré diamant nevytvára.
1. Ako oxidačné činidlo reaguje uhlík s niektorými kovmi pri vysokých teplotách a tvorí karbidy:
CS + 4Al = Al4C3 (karbid hliníka).
2. Vodík, uhlie a grafit vytvárajú uhľovodíky. Najjednoduchší zástupca - metán CH4 - sa môže získať v prítomnosti Ni katalyzátora pri vysokej teplote (600-1000 ° C):
CH 4.3. Pri interakcii s kyslíkom vykazuje uhlík znižujúce vlastnosti. Pri úplnom spaľovaní uhlíka akejkoľvek alotropickej modifikácie vzniká oxid uhoľnatý (IV):
C + O2 = C02.
Nekompletné spaľovanie vytvára oxid uhoľnatý (II) CO:
C + 02 = 2SO.
Obe reakcie sú exotermické.
4. Obzvlášť jasne sa redukujúce vlastnosti uhlia sa prejavujú pri interakcii s oxidmi kovov (zinok, meď, olovo atď.), Napríklad:
C + 2CuO = C02 + 2Cu,
C + 2ZnO = CO 2 + 2Zn.
Na týchto reakciách je založený najdôležitejší proces metalurgie - tavenie kovov z rúd.
V iných prípadoch, napríklad pri interakcii s oxidom vápenatým, sa vytvárajú karbidy:
CaO + ZS = CaC2 + CO.
5. Uhlie sa oxiduje horúcou koncentrovanou kyselinou sírovou a dusičnou:
C + 2H2S04 = C02 + 2S02 + 2H20,
3C + 4HN03 = 3C02 + 4NO + 2 H20.
Akákoľvek forma uhlíka odolná voči zásadám!
1.4. Použitie uhlíka
Diamanty sa používajú na spracovanie rôznych pevných materiálov, na rezanie, brúsenie, vŕtanie a gravírovanie skla, na vŕtanie skál. Po brúsení a rezaní sú diamanty premenené na diamanty, ktoré sa používajú ako šperky.
Grafit je najcennejším materiálom pre moderný priemysel. Odliatky, taviace tégliky a iné žiaruvzdorné výrobky sú vyrobené z grafitu. Vzhľadom na vysokú chemickú stabilitu sa grafit používa na výrobu potrubia a prístrojov vyložených grafitovými platňami zvnútra. Významné množstvo grafitu sa používa v elektrotechnickom priemysle, napríklad pri výrobe elektród. Grafit sa používa na výrobu ceruziek a niektorých farieb ako mazadla. Veľmi čistý grafit sa používa v jadrových reaktoroch na spomalenie neutrónov.
Lineárny uhlíkový polymér - karbín - priťahuje pozornosť vedcov ako sľubného materiálu pre výrobu polovodičov, ktoré môžu pracovať pri vysokých teplotách a ultra silné vlákna.
Uhlie sa používa v metalurgickom priemysle, v kováčstve.
Koks sa používa ako redukčné činidlo pri tavení kovov z rúd.
Sadze sa používajú ako gumová náplň na zvýšenie pevnosti, takže pneumatiky na automobily sú čierne. Sóda sa používa aj ako súčasť tlačiarenských farieb, riasenky, leštidla na topánky.
Aktívne uhlíky sa používajú na čistenie, extrakciu a oddeľovanie rôznych látok. Aktívne uhlíky sa používajú ako plnidlá na plynové masky a ako sorbent v medicíne.
hlava II , Anorganické zlúčeniny uhlíka
Uhlík tvorí dva oxidy - oxid uhoľnatý (CO) a oxid uhoľnatý (CO).
Oxid uhoľnatý (II) CO je bezfarebný plyn bez zápachu, zle rozpustný vo vode. Nazýva sa to oxid uhoľnatý, pretože je veľmi jedovatý. Pri vdychovaní do krvi sa rýchlo kombinuje s hemoglobínom, čím vytvára silnú zlúčeninu karboxyhemoglobínu, čím sa hemoglobín zbavuje schopnosti prenášať kyslík.
Pri dýchaní vzduchu obsahujúceho 0,1% CO môže osoba náhle stratiť vedomie a zomrieť. Oxid uhoľnatý vzniká pri nekompletnom spaľovaní paliva, čo je dôvod, prečo je nebezpečné predčasne uzavrieť komíny.
Oxid uhoľnatý (II) patrí, ako už viete, oxidom, ktorý nie je soľou, pretože ako nekovový oxid musí reagovať so zásadami a zásaditými oxidmi na vytvorenie soli a vody, čo však nie je pozorované.
2CO + 02 = 2CO2.
Oxid uhoľnatý (II) je schopný prijímať kyslík z oxidov kovov, t.j. na regeneráciu kovov z ich oxidov.
Fe2O3 + SOA = 2Fe + SOA 2.
Je to vlastnosť oxidu uhoľnatého (II) používaného v metalurgii pri tavení železa.
Oxid uhoľnatý (IV) C02 - bežne známy ako oxid uhličitý - je bezfarebný plyn bez zápachu. Je to asi jeden a pol násobne ťažší ako vzduch. Za normálnych podmienok sa jeden objem oxidu uhličitého rozpustí v 1 objeme vody.
Pri tlaku asi 60 atm sa oxid uhličitý zmení na bezfarebnú kvapalinu. Keď sa kvapalný oxid uhličitý odparí, časť z neho sa zmení na pevnú snehovú hmotu, ktorá je v priemysle tlačená - to je "suchý ľad", ktorý je známy pre vás, ktorý sa používa na skladovanie potravín. Už viete, že tuhý oxid uhličitý má molekulárnu mriežku schopnú sublimácie.
Oxid uhličitý CO 2 je typický oxid kyseliny: reaguje s alkalickými látkami (napríklad spôsobuje zakalenú vodu z vápna), s zásaditými oxidmi a vodou.
Nehorí a neudržiava spaľovanie, a preto sa používa na hasenie požiarov. Horčík však stále spaľuje oxid uhličitý, čím vytvára oxid a uvoľňuje uhlík vo forme sadzí.
C02 + 2Mg = 2MgO + C.
Oxid uhličitý sa získava pôsobením na soli kyseliny uhličitej - uhličitany roztokmi kyseliny chlorovodíkovej, dusičnej a dokonca aj kyseliny octovej. V laboratóriu sa oxid uhličitý vytvára pôsobením kyseliny chlorovodíkovej na kriedu alebo mramor.
CaC03 + 2HCl = CaCl2 + H20 + C02.
V priemysle sa oxid uhličitý získava spaľovaním vápenca:
CaCO3 = CaO + C2.
Oxid uhličitý, okrem už spomínanej aplikácie, sa používa aj na výrobu šumivých nápojov a na výrobu sódy.
Keď sa oxid uhličitý rozpustí vo vode, vytvára sa kyselina uhličitá H 2 CO 3, ktorá je veľmi nestabilná a ľahko sa rozkladá na jej počiatočné zložky - oxid uhličitý a vodu.
Ako kyselina dvojsýtna vytvára kyselina uhličitá dva rady solí: stredné uhličitany, napríklad CaC03 a kyslé hydrogenuhličitany, napríklad Ca (HCO3) 2. Z uhličitanov vo vode rozpustné len soli draslíka, sodíka a amoniaku. Kyslé soli sú všeobecne rozpustné vo vode.
Pri prebytku oxidu uhličitého v prítomnosti vody môžu byť uhličitany konvertované na hydrogenuhličitany. Ak sa teda oxid uhličitý prepadne vápennou vodou, najskôr sa kvôli vysrážanému vo vode nerozpustnému uhličitanu vápenatému zakalí, ale pri ďalšom prechode oxidu uhličitého zmizne zákal v dôsledku tvorby rozpustného hydrogenuhličitanu vápenatého:
CACO 3 + H 2O + CO 2 = Ca (HCO 3) 2.
Práve prítomnosť tejto soli vysvetľuje dočasnú tvrdosť vody. Prečo dočasné? Keď sa zohreje, rozpustný hydrogenuhličitan vápenatý sa znova prevedie na nerozpustný uhličitan:
Ca (HCO3) 2 = CaC03 + H20 + Co2.
Táto reakcia vedie k tvorbe špiny na stenách kotlov, parných vykurovacích potrubí a domácich kotlov av prírode v dôsledku tejto reakcie visí podivné stalaktity visiace z jaskýň, ku ktorým stúpajú stalagmity zospodu.
Iné soli vápnika a horčíka, najmä chloridy a sírany, poskytujú vodu konštantnú tuhosť. Varená trvalá tvrdosť vody nemožno odstrániť. Musíme použiť iný uhličitan sodný.
Na2C03, ktorý konvertuje tieto Ca2 + ióny na sediment, napríklad:
L2 + Na2C03 = CaC03 + 2NaCl.
Soda môže byť tiež použitá na odstránenie dočasnej tvrdosti vody.
Uhličitany a hydrogenuhličitany sa môžu detegovať pomocou kyslých roztokov: pri vystavení kyselinám sa pozoruje charakteristický "vrieť" v dôsledku uvoľňovaného oxidu uhličitého.
Táto reakcia je kvalitatívnou reakciou na soli kyseliny uhličitej.
záver
Celý pozemský život je založený na uhlíku. Každá molekula živého organizmu je postavená na základe uhlíkového skeletu. Atómy uhlíka neustále migrujú z jednej časti biosféry (úzkeho plášťa Zeme, kde život existuje) druhému. Pomocou uhlíkového cyklu v prírode ako príkladu môžeme sledovať obraz života na našej planéte v dynamike.
Hlavné uhlíkové zásoby na Zemi sú vo forme oxidu uhličitého v atmosfére a rozpustené v oceánoch, to znamená oxidu uhličitého (CO 2). Najskôr zvážte molekuly oxidu uhličitého v atmosfére. Rastliny absorbujú tieto molekuly, potom sa v procese fotosyntézy uhlíkový atóm premení na rôzne organické zlúčeniny a tak sa začlení do štruktúry rastlín. Ďalej existuje niekoľko možností:
1. Uhoľ môže zostať v rastlinách, kým rastliny zomrú. Potom sa ich molekuly dostanú do potravy k rozkladajúcim látkam (organizmom, ktoré sa živia mŕtvou organickou hmotou a súčasne ju zničia jednoduchými anorganickými zlúčeninami), ako sú huby a termity. Nakoniec sa uhlík vráti do atmosféry ako CO 2;
2. Rastliny môžu byť konzumované bylinožravcami. V tomto prípade sa uhlík buď vráti do atmosféry (v procese dýchania zvierat a keď sa rozpadne po smrti), alebo by býložravé zvieratá konzumujú mäsožravce (a potom sa uhlík opäť vráti do atmosféry rovnakým spôsobom);
3. rastliny môžu zomrieť a skončiť pod zemou. Potom sa nakoniec premení na fosílne palivá - napríklad uhlie.
V prípade rozpustenia pôvodnej molekuly CO 2 v morskej vode je možné aj niekoľko možností:
Oxid uhličitý sa môže jednoducho vrátiť do atmosféry (tento typ vzájomnej výmeny plynu medzi oceánmi a atmosférou sa stáva po celý čas);
Uhlík môže vstúpiť do tkanív morských rastlín alebo zvierat. Potom sa postupne nahromadí v podobe sedimentov na dne oceánov a nakoniec sa zmení na vápenec alebo z usadenín sa zase zmení na morskú vodu.
Ak je uhlík súčasťou sedimentu alebo fosílnych palív, odstraňuje sa z atmosféry. Počas existencie Zeme bol takto odstránený uhlík nahradený oxidom uhličitým, ktorý bol vypúšťaný do ovzdušia počas vulkanických erupcií a iných geotermálnych procesov. V moderných podmienkach sa do týchto prírodných faktorov pridávajú aj emisie z spaľovania fosílnych palív. Vzhľadom na vplyv CO 2 na skleníkový efekt sa štúdium uhlíkového cyklu stalo dôležitou úlohou pre vedcov, ktorí skúmajú atmosféru.
Súčasťou tohto vyhľadávania je aj stanovenie množstva CO 2, ktoré sa nachádza v rastlinných tkanivách (napríklad v novo vysadenom lese) - vedci to nazývajú záchyt uhlíka. Keďže vlády rôznych krajín sa snažia dosiahnuť medzinárodnú dohodu o obmedzení emisií CO 2, otázka vyváženého pomeru záchytov a emisií uhlíka v jednotlivých štátoch sa stala hlavnou kosťou konfliktu pre priemyselné krajiny. Vedci však pochybujú, že akumuláciu oxidu uhličitého v atmosfére možno zastaviť len na plantážach.
Uhlie neustále cirkuluje v suchozemskej biosfére prostredníctvom uzavretých vzájomne prepojených ciest. V súčasnosti sa účinky spaľovania fosílnych palív pridávajú do prírodných procesov.
Referencie:
1. Akhmetov N.S. Chémia 9. ročník: štúdie. pre všeobecné vzdelávanie. Proc. inštitúcie. - 2. vyd. - M .: Education, 1999. 175 p .: Il.
2. Gabrielyan O.S. Chémia 9. ročník: štúdie. pre všeobecné vzdelávanie. Proc. inštitúcie. - 4. vyd. - M .: Drofa, 2001. - 224 s., Ill.
3. Gabrielyan O.S. Chémia stupňa 8-9: metóda. Príspevok. - 4. vyd. - M .: Drofa, 2001. - 128 s.
4. Eroshin D.P., Shishkin E.A. Metódy riešenia problémov v chémii: štúdie. Príspevok. - M .: Enlightenment, 1989. 176 pp., Ill.
5. Kremenchug M. Chémia: Príručka študenta. - M .: Filol. Spoločnosť "WORD": Izd-vo AST, LLC, 2001. - 478 s.
6. Kritsman V.A. Kniha čítať anorganickú chémiu. - M .: Enlightenment, 1986. - 273 p.