Výpočet výkonu pre prúd a napätie
Ako viete, elektrické napätie by malo mať svoje vlastné opatrenie, ktoré na začiatku zodpovedá hodnote, ktorá ...
Carbon.
Uhlík (Carboneum), C - chemický prvok skupiny IV, sekundárna podskupina, 2. obdobie periodického systému DI Mendeleev, sériové číslo 6. Relatívna atómová hmotnosť: 12,011. Elektronegativita: 2.6. Teplota topenia: 3370 ° C (popáleniny). Teplota varu: 4200 ° С. Hustota (grafit): 2,27 g / cm. Počet uhlíkových minerálov je 112; počet organických zlúčenín uhlíka - uhľovodíkov a ich derivátov - je mimoriadne veľký. Uhlík sa nachádza v prírode vo voľnom stave (vo forme diamantu, grafitu) a vo forme zlúčenín (obsiahnutých v horľavých bridliciach, hnedé a bitúmenové uhlie, rašelina a vo forme zlúčenín v rope, prírodných horľavých plynoch, uhličitane). Všetky živé organizmy sú vyrobené z uhlíkových zlúčenín. Uhlík je rozšírený, ale jeho obsah v zemskej kôre je len 0,19%; aj uhlík je vo vesmíre rozšírený; na Slnku, zaujme 4. miesto po vodíku, héliu a kyslíku. V porovnaní s priemerným obsahom zemskej kôry ľudstvo extrahuje uhlík z hlbín (uhlie, ropa, zemný plyn) v mimoriadne veľkých množstvách, pretože tieto minerály sú hlavným zdrojom energie.
Historické zázemie. V roku 1778 K. Scheele, zahrievajúci grafit s dusičnanmi, zistil, že zatiaľ čo sa dusík nasýtený oxidom uhličitým, uvoľňuje oxid uhličitý. Chemické zloženie diamantu bolo založené na výsledkoch experimentov A. Lavoisiera (1772) o štúdiu spaľovania diamantov vo vzduchu a štúdiách S. Tennanta (1797), ktorí dokázali, že rovnaké množstvo diamantu a uhlia pri oxidácii poskytuje rovnaké množstvo oxidu uhličitého. Uhoľ bol uznaný ako chemický prvok v roku 1789 Lavoisierom. Latinský názov "uhlík" uhlík odvodený z "carbo" - uhlie. A v roku 1961 získali Medzinárodné združenia teoretickej a aplikovanej chémie (IUPAC) a vo fyzike hmotnosť 12C uhlíkového izotopu ako jednotku atómovej hmoty, čím sa eliminovala kyslíková mierka atómových hmôt, ktorá existovala predtým. Atomová hmotnosť uhlíka v tomto systéme je 12 011, pretože je priemerná pre tri prírodné izotopy uhlíka, berúc do úvahy ich hojnosť v prírode.
Uhoľný uhlíok bol známy už od staroveku. Dlho je známe, že iný materiál môže byť označený grafitom a samotný názov "grafit" odvodený z gréckeho slova, ktorý znamená "písať", navrhol A. Verner v roku 1789. História grafitu je však zmätená, často s látkami s podobnými vonkajšími fyzikálnymi vlastnosťami. , napríklad molybdenit (sulfid molybdénu), bol naraz považovaný za grafit. Medzi ďalšie mená grafitu sú známe "čierne olovo", "karbidové železo", "strieborné olovo". V roku 1779 K. Scheele zistil, že grafit môže byť oxidovaný vzduchom za vzniku oxidu uhličitého.
Diamanty sa prvýkrát používali v Indii av Brazílii získali drahé kamene v roku 1725 obchodný význam; Vklady v Južnej Afrike boli objavené v roku 1867. V 20. storočí sú hlavnými výrobcami diamantov Južná Afrika, Zaire, Botswana, Namíbia, Angola, Sierra Leone, Tanzánia a Rusko. Umelé diamanty, ktorých technológia vznikla v roku 1970, sa vyrábajú na priemyselné účely.
Fyzikálne a chemické vlastnosti. Sú známe štyri modifikácie kryštalického uhlíka: grafit, diamant, karbín a lonštalit. grafit - šedo-čierna, nepriehľadná, mastná na dotyk, šupinatá, veľmi jemná hmotnosť s kovovým leskom, má elektrickú vodivosť. Atómy sú usporiadané v rovnobežných vrstvách a vytvárajú šesťuholníkovú mriežku. Vo vnútri vrstvy sú atómy viazané silnejšie ako jedna vrstva s druhou, preto grafit môže byť stratifikovaný. Spája pri 700 ° C v prítomnosti kyslíka. Vyskytuje sa v prírode; Ukázalo sa to umelo. Pri vysokej teplote, tlaku a prítomnosti katalyzátora (mangán Mn, chróm Cr, platinové kovy) sa grafit mení na diamant. diamant - minerál so žltkastou, bielou, šedou, zelenkavou, menej často modrou a čiernou farbou. Nevedie elektrický prúd, nesprávne vedie teplo. V kryštáliku vytvárajú atómy uhlíka nepretržitú trojrozmernú štruktúru pozostávajúcu z kĺbových štvorcestov, ktoré zabezpečujú vysokú pevnosť spoja. Diamant je najťažšia látka, ktorá je vždy známa. Teplota topenia nad 3500 ° С. Chemicky odolné. Spája pri 870 ° C v prítomnosti kyslíka. Pri 1800 ° C v neprítomnosti kyslíka sa mení na grafit. Číre kryštály; po spracovaní - diamanty. Je extrahovaný z nábehových a primárnych usadenín. Syntetický diamant sa získava z grafitu pri vysokom tlaku a teplote. Je často priesvitný alebo nepriehľadný; Má kryštalickú štruktúru a vlastnosti prírodného diamantu. Tekutý uhlík možno získať pri tlakoch vyšších ako 10,5 Mn / m2 (105 kgf / cm2) a teplotách vyšších ako 3700 ° C Koks, sadze, uhlie ( tuhého uhlíka ) majú rovnakú štruktúru ako grafit. Pre tuhý uhlík je charakteristický aj stav s neusporiadanou štruktúrou - tzv "amorfný" uhlík ktorá nie je vlastnou zmenou; V srdci svojej štruktúry je štruktúra kryštalického grafitu. Ohrev niektorých odrôd "amorfného" uhlíka nad 1500-1600 ° C bez prístupu vzduchu spôsobuje ich premenu na grafit. Fyzikálne vlastnosti "amorfného" uhlíka sú veľmi závislé od disperzie častíc a prítomnosti nečistôt. Hustota, tepelná kapacita, tepelná vodivosť a elektrická vodivosť "amorfného" uhlíka sú vždy vyššie ako grafit. karabína získané umelo. Je to jemnozrnný čierny prášok (hustota = 2 g / cm). Konštruované z dlhých reťazcov atómov C položených rovnobežne navzájom. Lonsdale zistené v meteoritoch a umelo získané; jeho štruktúra a vlastnosti nie sú úplne stanovené.

A B
Štruktúra diamantu (a) a grafitu (b).
Konfigurácia vonkajšieho elektrónového obalu atómu uhlíka 2sІ 2pІ , Uhlík je charakterizovaný tvorbou štyroch kovalentných väzieb v dôsledku excitácie vonkajšieho elektrónového puzdra do stavu 2SPі , Chemické spojenie môže byť vykonané pomocou sp3 -, sp2 - a sp- hybridné orbitály, ktoré zodpovedajú koordinačným číslam 4, 3 a 2. Počet valenčných elektrónov uhlíka a počet valenčných orbitálov sú rovnaké; To je jeden z dôvodov pre stabilitu väzby medzi atómami uhlíka.

Štruktúra uhlíkového atómu.
Jedinečná schopnosť atómov uhlíka kombinovať s tvorbou silných a dlhých reťazcov a cyklov viedla k vzniku obrovského množstva rôznych uhlíkových zlúčenín (uhľovodíkov) študovaných organickou chémiou.
V zlúčeninách má uhlík oxidačné stavy -4; +2; 4. Atómový rádius 0,77B, kovalentné polomery 0,77B, 0,67B, 0,60B v jednotlivých, dvojitých a trojitých väzbách; iónový rádius
C4 - 2, 60B, C4 + 0,20B. Za normálnych podmienok je uhlík chemicky inertný, pri vysokých teplotách sa spája s mnohými prvkami, ktoré vykazujú silné redukčné vlastnosti. Chemická aktivita klesá v rade: "amorfný" uhlík, grafit, diamant; interakcia s kyslíkom vo vzduchu (spaľovanie) nastáva pri teplotách nad 300-500 ° C, 600-700 ° C a 850-1000 ° C pri tvorbe oxidu uhličitého CO2 a oxidu uhoľnatého CO.
CO2 sa rozpúšťa vo vode za vzniku kyseliny uhličitej. V roku 1906 prijal O. Diels oxid uhličitý C302. Všetky formy uhlíka sú odolné voči zásadám a kyselinám a sú pomaly oxidované len veľmi silnými oxidačnými činidlami (zmesou chrómu, zmesou koncentrovanej HNO3 a KClO3 atď.). "Amorfný" uhlík reaguje s fluór pri teplote miestnosti, grafitu a diamantu - pri zahrievaní. Priama zmes uhlíka s chlór dochádza v elektrickom oblúku; s bróm a jód Uhlík nereaguje, preto sú nepriamo syntetizované početné uhličitany. Z oxyhalogenidov všeobecného vzorca COX2 (kde X je halogén) je najznámejšou chlóroxidom COCI2 (fosgén). vodík nereaguje s diamantom; s grafitom a "amorfným" uhlíkom reaguje pri vysokých teplotách za prítomnosti katalyzátorov (nikel nikelnatý, platina Pt): pri 600-1000 ° C vzniká hlavne metán CH4, pri 1500-2000 ° C - acetylén C2H2, môžu byť prítomné aj iné uhľovodíky vo výrobkoch C2H6, benzén C6H6. interakcie síra s "amorfným" uhlíkom a grafitom začína pri 700-800 ° C, s diamantom pri 900-1000 ° C; vo všetkých prípadoch sa tvorí sulfid uhličitý CS2. Ostatné zlúčeniny uhlíka obsahujúce síru (CS Thioxid, C3S2 tiooxid, COS oxid síry a CSCI2 tiofosgén) sa získavajú nepriamo. Keď CS2 interaguje s sulfidmi kovov, vytvárajú sa tiokarbonáty - soli slabej kyseliny tiogolovej. Uhlíková interakcia s dusík na výrobu azúru (CN) 2, dochádza pri prechode elektrickým výbojom medzi uhlíkovými elektródami v dusíkovej atmosfére. Medzi dusíkatými zlúčeninami uhlíka sú dôležité kyanovodík HCN a jeho početné deriváty: kyanidy, halogenidy, nitrily atď. Pri teplotách nad 1000 ° C uhlík reaguje s mnohými kovmidávajúce karbidy. Všetky formy uhlíka redukujú oxidy kovov pri zahrievaní za vzniku voľných kovov (Zn, Cd, Cu, Pb atď.) Alebo karbidov (CaC2, Mo2C, WC, TaC atď.). Uhlík reaguje pri teplotách nad 600-800 ° C vodná para a oxid uhličitý. Charakteristickým rysom grafitu je schopnosť interagovať s alkalickými kovmi a halogenidmi so stredným ohrevom až na 300 až 400 ° C za vzniku inklúznych zlúčenín ako sú C8Me, C24Me, C8X (kde X je halogén, Me je kov). Známe zlúčeniny zahŕňajú grafit s HN03, H2S04, FeCl3 a ďalšími (napríklad grafitový bisulfát C24S04H2). Všetky formy uhlíka sú nerozpustné v bežných anorganických a organických rozpúšťadlá, ale rozpúšťa sa v niektorých roztavených kovoch (napríklad železo Fe, nikel nikel, kobalt Co).
Uhlíkové izotopy. V prírode sú známe sedem uhlíkových izotopov, z ktorých tri zohrávajú významnú úlohu. Dve z nich sú - a - sú stabilné a jeden je - rádioaktívny (obsahuje asi 0,1 v ľudskom tele curie). Mnohé významné pokroky vo výskume metabolizmu a uhlíkového cyklu v prírode súvisia s použitím izotopov uhlíka v biologickom a lekárskom výskume. Takto sa pomocou rádioaktívneho značenia preukázala možnosť fixácie H14C03 rastlinami a živočíšnymi tkanivami, bola stanovená sekvencia fotosyntéznej reakcie, študoval sa metabolizmus aminokyselín, boli sledované cesty biosyntézy mnohých biologicky aktívnych zlúčenín atď. Použitie zlúčeniny 14C prispelo k úspechu biosyntézy a prenosu proteínov dedičných informácií. Stanovenie špecifickej aktivity 14C v organických zvyškoch obsahujúcich uhlík umožňuje posúdiť ich vek, ktorý sa používa v paleontológii a archeológii.
Uhlík v tele. Uhlík je najdôležitejším biogénnym prvkom, ktorý tvorí základ života na Zemi, štruktúrnej jednotky obrovského množstva organických zlúčenín, ktoré sa podieľajú na konštrukcii organizmov a ich živobytie (biopolyméry, ako aj početné nízkomolekulárne biologicky aktívne látky - vitamíny, hormóny, mediátory atď.). Značná časť energie, ktorú vyžadujú organizmy, sa produkuje v bunkách v dôsledku oxidácie uhlíka. Vznik života na Zemi sa v modernej vede považuje za zložitý proces vývoja uhlíkových zlúčenín.
Úloha uhlíka vo voľnej prírode. Unikátna úloha uhlíka v živote je spôsobená jeho vlastnosťami, ktoré spoločne nemajú žiadny iný prvok periodického systému. Medzi atómami uhlíka, ako aj medzi uhlíkom a ďalšími prvkami sa vytvárajú silné chemické väzby, ktoré však môžu byť zlomené za relatívne miernych fyziologických podmienok (tieto väzby môžu byť jednoduché, dvojité alebo trojité). Schopnosť uhlíka vytvoriť 4 ekvivalentné valenčné väzby s inými atómami uhlíka umožňuje vytvoriť uhlíkové kostry rôznych typov - lineárne, rozvetvené, cyklické. Je dôležité, že iba tri prvky - uhlík C, kyslík O a vodík H - tvoria 98% celkovej hmotnosti živých organizmov. Tým sa dosahuje určitá hospodárska účinnosť v živote: s takmer neobmedzenou štrukturálnou rozmanitosťou zlúčenín uhlíka môže malý počet chemických väzieb významne znížiť počet enzýmov potrebných na štiepenie a syntézu organických látok. Štruktúrne črty uhlíkového atómu sú základom rôznych typov izomerizácie organických zlúčenín (schopnosť opticky izomerizovať bola rozhodujúca v biochemickom vývoji aminokyselín, sacharidov a niektorých alkaloidov).
Podľa všeobecne uznávanej hypotézy A. I. Oparina boli prvé organické zlúčeniny na Zemi abiogénneho pôvodu. Zdroje uhlíka boli metán (CH4) a kyanovodík (HCN) obsiahnuté v primárnej atmosfére Zeme. S výskytom života je jediným zdrojom anorganického uhlíka, vďaka ktorému sa tvorí všetka organická hmota biosféry, oxid uhličitý (CO2) v atmosfére a tiež rozpustený v prírodných vodách vo forme HCO-3. Najsilnejším mechanizmom asimilácie (asimilácie) uhlíka (vo forme CO2) - fotosyntézy - sa vykonáva všade v zelených rastlinách (asi 100 miliárd ton CO2 sa každoročne asimiluje). Na Zemi existuje evolučne starší spôsob asimilácie CO2 pomocou chemosyntézy; V tomto prípade chemosyntetické mikroorganizmy nepoužívajú sálavú energiu Slnka, ale energiu oxidácie anorganických zlúčenín. Väčšina zvierat spotrebuje uhlík z potravy vo forme hotových organických zlúčenín. V závislosti od metódy asimilácie organických zlúčenín je zvykom rozlišovať autotrofné organizmy a heterotrofné organizmy. Použitie bielkovín a iných živín mikroorganizmov na biosyntézu, ktoré používajú ropné uhľovodíky ako jediný zdroj uhlíka, je jedným z dôležitých moderných vedeckých a technických problémov.
Okrem hlavnej funkcie - zdrojom uhlíka - oxidu uhličitého CO2, rozpustený v prírodných vodách av biologických tekutinách, sa podieľa na zachovaní kyslosti životného prostredia, ktorá je optimálna pre životne dôležité procesy. V zložení CaCO3 vytvára uhlík vonkajšiu kostru mnohých bezstavovcov (napríklad mäkkýšov) a nachádza sa tiež v koraloch, vtákoch z vajec atď. Uhlíkové zlúčeniny ako HCN, CO, CCI4, ktoré prevládali v primárnej atmosfére Zeme , v procese biologického vývoja, sa zmenil na silné antimetabolity metabolizmu.
Cyklus uhlíka. Uhlík je hlavnou živinou; Zohráva dôležitú úlohu pri formovaní živých látok biosféry. Oxid uhličitý z atmosféry v procese fotosyntézy, ktorý sa vykonáva zelenými rastlinami, sa asimiluje a mení sa na rôznorodé a početné organické zlúčeniny rastlín. Rastlinné organizmy, najmä nižšie mikroorganizmy, morský fytoplanktón, vzhľadom na mimoriadnu reprodukčnú rýchlosť, produkujú asi 1,5 · 10 č. Ton uhlíka vo forme organickej hmoty za rok, čo zodpovedá
5,86 · 10 J (1,4 · 10 »C) energie. Rastliny sú čiastočne konzumované zvieratami (s tvorbou viac-menej komplexných potravinových reťazcov). V konečnom dôsledku organická hmota v dôsledku dýchania organizmov, rozkladu ich mŕtvol, fermentácie, rozpadu a procesov spaľovania sa mení na oxid uhličitý alebo sa ukladá vo forme sapropelu, humusu, rašeliny, čo zase vedie k vzniku mnohých ďalších kasobiolitov - uhlia, olej, horľavé plyny.

Cyklus uhlíka.
Pri procesoch rozkladu organických látok a ich mineralizácii zohrávajú baktérie obrovskú úlohu (napríklad hnilobné), rovnako ako mnohé huby (napríklad plísňové huby).
Veľmi malá časť celej svojej hmotnosti sa podieľa na aktívnom uhlíkovom cykle. Obrovské množstvo kyseliny uhličitej konzervované vo forme fosílnych vápencov a iných horninách. Na druhej strane dochádza k pohybujúcej sa rovnováhe medzi oxidom uhličitým v atmosfére a oceánskou vodou.
Tabuľka: Obsah uhlíka na povrchu Zeme a v zemskej kôre (16 km výkonu)
t g dňa 1 vidieťI povrchu Zeme
Zvieratá 5 · 109 0,0015
Rastliny 5 · 10№№ 0,1
Atmosféra 6,4 · 10 · 0,125
Ocean 3.8 · 10 · 7.5
Masívne kryštalické
skaly: bazaltové a iné 1,7 · 1014 33,0
hlavné plemeno
Granity, granodiority 2,9 · 1015 567
Uhlie, ropa a iné
caustobiolity 6,4 · 1015 663
Krištáľové skaly 1 · 1016 2000
Uhličitany 1,3 · 1016 2500
Celkom 3,2 · 1016 5770
Mnoho vodných organizmov absorbuje uhličitan vápenatý, vytvára ich kostry a potom tvoria vrstvy vápence. Atmosféra bola extrahovaná a zakopaná desiatkami tisíckrát väčším množstvom oxidu uhličitého, ako je v súčasnosti. Atmosféra sa dopĺňa oxidom uhličitým v dôsledku procesov rozkladu organických látok, uhličitanov atď., A tiež čoraz viac v dôsledku priemyselnej činnosti človeka. Obzvlášť silným zdrojom sú sopky, ktorých plyny pozostávajú najmä z oxidu uhličitého a vodnej pary. Časť oxidu uhličitého a vody vypuknutých sopkami sa znovu zrodí z sedimentárnych hornín, najmä z vápenca, keď magma príde do kontaktu s nimi a ich asimilácia magmatou. V procese cirkulácie uhlíka sa pri biogénnej tvorbe organických látok (uhlie, olej, tkanivo, organizmy atď.) Opakovane frakcionuje izotopovým zložením (č. IC - č. C), najmä v magmatickom procese (tvorba CO2, diamantov, uhličitanov).
Použitie uhlíka. Uhlík sa široko používa vo forme jednoduchých látok. vzácny diamant je predmetom šperkov; Neprístupný diamant je cenný brúsny materiál, ako aj materiál na výrobu rezákov a iných nástrojov. drevené uhlie a iné amorfné formy uhlíka sa používajú na bielenie, čistenie, adsorpciu plynu v oblastiach technológií, kde sú potrebné adsorbenty s rozvinutým povrchom. grafit používané na výrobu taviacich téglikov, obkladových dosiek, elektród, tuhých mazív; v raketovej technológii; ako neutronový moderátor v jadrových reaktoroch; zloženie zložiek na výrobu tyčiniek pre arandas; pre diamanty; plniace plasty. uhlie koks používané v železnej metalurgii ako palivo a redukčné činidlo vo vysokých peciach a kupolových peciach. Koks z ropy a elektródy sa používa na výrobu uhlia a grafitizovaných elektród, menej často ako palivo. sadze (sadze) sa používa ako plnivo pri výrobe kaučuku a plastov; pigment v priemysle farieb; na výrobu elektród atď. karbidy, zlúčeniny uhlíka s kovmi, ako aj bór a kremík (napríklad Al4C3, SiC, B4C) sa vyznačujú vysokou tvrdosťou a používajú sa na výrobu brúsnych a rezných nástrojov. uhlík používané na výrobu kovov z ich oxidov. Uhlík je súčasťou ocele a zliatin v elementárnom stave a vo forme karbidov. Nasýtenie povrchu oceľových odliatkov s uhlíkom pri vysokej teplote (cementácia) výrazne zvyšuje tvrdosť povrchu a odolnosť proti opotrebovaniu.

Diamant v šperku,
grafit v tužkách.
Referencie:1) Veľká školská encyklopédia, zväzok 2, vyd. "Olma-Press"
2) Internet: www.encycl.yandex, www.krugosvet, wwwrmika.
Po dve desaťročia za sebou bolo uhlie v tieni ropného boomu. Hory uhlia, ktoré sa nepredávali, sa rozrástli na oblohu. Množstvo baní vypnuté, stovky tisíc baníkov stratili prácu. Apalačská oblasť Spojených štátov, kedysi prekvitajúca uhoľná panva, sa stala jednou z najznepokojenejších oblastí chudoby ...
Štruktúra atómu vodíka v periodickom systéme. Stupeň oxidácie. Prevalencia v prírode. Vodík ako jednoduchá látka, ktorého molekuly pozostávajú z dvoch atómov navzájom spojených kovalentnou nepolárnou väzbou. Fyzikálne a chemické vlastnosti.
Diamond. Slovo "diamant" okamžite pripomína obalené tajomné príbehy, ktoré hovoria o vyhladávaní pokladov. Niekedy ľudia, ktorí hľadali diamanty, netušili, že ich vášeň je kryštalický uhlík - samotný uhlík, ktorý tvorí sadze, sadze a uhlie. .V ...
Informácie o uhlíku, datuje sa od staroveku a jeho rozloženie v prírode. Prítomnosť uhlíka v kôre. Fyzikálne a chemické vlastnosti uhlíka. Výroba a použitie uhlíka a jeho zlúčenín. Adsorpčná kapacita aktívneho uhlia.
Chemické vlastnosti jednoduchých látok. Všeobecné informácie o uhlíku a kremíku. Chemické zlúčeniny uhlíka, jeho kyslík a deriváty obsahujúce dusík. Karbidy, rozpustné a nerozpustné vo vode a zriedených kyselinách. Kyslíkaté zlúčeniny kremíka.
Uhlík (C) - typické nekovové; v periodickom systéme je v druhej perióde IV skupina, hlavná podskupina. Sekvenčné číslo 6, Ar = 12,011 amu, jadrový náboj +6.Fyzikálne vlastnosti: uhlík vytvára veľa alotropických modifikácií: diamant - jedna z najťažších látok grafit, uhlie, sadze.
Atóm uhlíka má 6 elektrónov: 1s 2 2s 2 2p 2 . Posledné dva elektróny sú umiestnené na samostatných p-orbitaloch a sú nepárové. V zásade by tento pár mohol obsadiť jediný orbitálny, avšak v tomto prípade sa elektrón-odpudok elektrónov značne zvyšuje. Z tohto dôvodu jeden z nich má 2p x, druhý je alebo 2p y , alebo 2p z-orbitálov.
Rozdiel medzi energiou s- a p-podkladových vrstiev vonkajšej vrstvy je malý, takže atóm pomerne ľahko prechádza do excitovaného stavu, v ktorom jeden z dvoch elektrónov z orbitalu 2s prechádza do voľného 2p. Nastáva stav valencie s konfiguráciou 1s 2 2s 1 2p x 1 2p y 1 2p z 1 . Práve tento stav atómu uhlíka je charakteristický pre diamantovú mriežku - tetraedrické priestorové usporiadanie hybridných orbitalov, rovnakej dĺžky a energie väzieb.
Tento jav je známy ako nazývaný sp3 hybridizácia a výsledné funkcie sú sp3 hybridné . Tvorba štyroch sp3 väzieb poskytuje stabilnejší uhlíkový atóm ako tri p-p a jedno s-s pripojenie. Okrem sp3 hybridizácie na atóme uhlíka sa tiež pozorujú sp2 a sp hybridizácia. . V prvom prípade dochádza k vzájomnému prekrývaniu. s- a dve p-orbitály. Vytvoria sa tri ekvivalentné sp 2 - hybridné orbitály, ktoré sa nachádzajú v rovnakej rovine v uhle 120 °. Tretia orbita p je nezmenená a smeruje kolmo k rovine. sp 2.

Pri sp hybridizácii sa s alebo p orbitály prekrývajú. Uhol 180 ° vzniká medzi dvoma ekvivalentnými hybridnými orbitalmi, ktoré sa tvoria, pričom dva p orbity na každom z atómov zostávajú nezmenené.
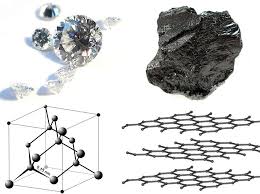
Uhlíková alotropia. Diamant a grafit
V grafitovom kryštáliku sú atómy uhlíka umiestnené v rovnobežných rovinách, ktoré zaberajú vrcholy pravidelných šesťuholníkov. Každý z atómov uhlíka je spojený s tromi susednými sp2 hybridnými väzbami. Spojenie medzi rovnobežnými rovinami je spôsobené silami van der Waals. Voľné p-orbitály každého atómu sú smerované kolmo na roviny kovalentných väzieb. Ich prekrytie vysvetľuje dodatočnú π-väzbu medzi atómami uhlíka. Takže od valenčný stav, v ktorom sú atómy uhlíka v látke, závisí od vlastností tejto látky.
Najcharakteristickejšie oxidačné stavy sú: +4, +2.
Pri nízkych teplotách je uhlík inertný, ale pri zahrievaní sa jeho aktivita zvyšuje.
- s kyslíkom
C 0 + O 2 - t ° = CO 2 oxid uhličitý
s nedostatkom kyslíka - neúplné spaľovanie:
2C 0 + 02 - t ° = 2C + 20 oxid uhoľnatý
- s fluórom
C + 2F2 = CF4
- s vodnou parou
C 0 + H 2 O - 1200 ° C = C + 20 + vodný plyn
- s oxidmi kovov. Takto tavený kov z rudy.
C 0 + 2CuO - t ° = 2Cu + C +4 02
- s kyselinami - oxidačné činidlá:
C0 + 2H2S04 (konc.) = C + 4O2 + 2S02 + 2H20
C0 + 4HNO3 (konc.) = C + 4O2 + 4NO2 + 2H20
- so sírou tvorí sírouhlíka:
C + 2S2 = CS2.
- tvorí karbidy s niektorými kovmi
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
- s vodíkom - metánom (rovnako ako s obrovským množstvom organických zlúčenín)
C0 + 2H2 = CH4
- s kremíkom tvorí karborundum (pri 2000 ° C v elektrickej peci):
Voľný uhlík sa nachádza vo forme diamantu a grafitu. Vo forme zlúčenín sa nachádza uhlík v zložení minerálov: krieda, mramor, vápenec - CaCO 3, dolomit - MgCO 3 * CaCO 3; uhličitany - Mg (HCO3) 2 a Ca (HCO3) 2, C02 je súčasťou ovzdušia; uhlík je hlavnou zložkou prírodných organických zlúčenín - plyn, olej, uhlie, rašelina, je súčasťou organickej hmoty, bielkovín, tukov, uhľohydrátov a aminokyselín, ktoré tvoria živé organizmy.

Anióny C 4+ ani C 4 sa nevytvárajú pri bežných chemických procesoch: v uhlíkových zlúčeninách existujú kovalentné väzby s rôznou polaritou.
Oxid uhoľnatý; bezfarebný, bez zápachu, mierne rozpustný vo vode, rozpustný v organických rozpúšťadlách, jedovatý, t ° kip = -192 ° C; t pl. = -205 ° C.
recepcia
1) V priemysle (v plynových generátoroch):
C + O2 = C02
2) V laboratóriu - tepelným rozkladom kyseliny mravčej alebo kyseliny šťaveľovej v prítomnosti H2S04 (konc.):
HCOOH = H20 + CO
H2C204 = CO + C02 + H20
Chemické vlastnosti
Za normálnych podmienok je CO inertný; pri zahrievaní - redukčným činidlom; neformujúci oxid.
1) s kyslíkom
2C + 2O + 02 = 2C + 4O2
2) s oxidmi kovov
C + 20 + CuO = Cu + C + 4O2
3) s chlórom (vo svetle)
CO + Cl2 - hn = COCI2 (fosgén)
4) reaguje s alkalickými taveninami (pod tlakom)
CO + NaOH = HCOONa (mravčan sodný)
5) tvorí karbonyly s prechodnými kovmi
Ni + 4CO-t ° = Ni (CO) 4
Fe + 5CO-t ° = Fe (CO) 5
Oxid uhličitý, bezfarebný, bez zápachu, rozpustnosť vo vode - 0,9 VCO2 sa rozpúšťa v 1 V H 2 O (za normálnych podmienok); ťažší ako vzduch; t ° pl. = -78,5 ° C (tuhý C02 sa nazýva "suchý ľad"); nepodporuje pálenie.
recepcia
CaCO3 - t ° = CaO + C02
CaCO3 + 2HCl = CaCl2 + H20 + C02
NaHC03 + HCI = NaCI + H20 + C02
chemickývlastnostiCO2
Oxid kyseliny: reaguje s bázickými oxidmi a bázami za vzniku solí kyseliny uhličitej
Na20 + C02 = Na2C03
2NaOH + C02 = Na2C03 + H20
NaOH + C02 = NaHC03
Pri zvýšených teplotách môžu vykazovať oxidačné vlastnosti.
C + O2 + 2Mg - t ° = 2Mg + 20 + C0
Kvalitatívna reakcia
Zákal vápna:
Ca (OH) 2 + C02 = CaC03 (biela zrazenina) + H20
Zmizne s predĺženým prenosom CO 2 cez vápennú vodu, pretože nerozpustný uhličitan vápenatý prechádza do rozpustného bikarbonátu:
CaCO3 + H20 + C02 = Ca (HCO3) 2
H 2CO3 -Kyselina je slabá, existuje len vo vodnom roztoku:
CO 2 + H 2 O ↔ H 2 CO 3
dvojsytného:
H 2 CO 3 ↔ H + + HCO 3 - Kyslé soli - hydrogenuhličitany, hydrogenuhličitany
HCO 3 - ↔ H + + CO 3 2- Stredné soli - uhličitany
Všetky vlastnosti kyselín sú charakteristické.
Uhličitany a hydrogenuhličitany sa môžu vzájomne premieňať:
2NaHCO3 - t ° = Na2C03 + H20 + C02
Na2C03 + H20 + C02 = 2NaHC03
Uhličitany kovov (s výnimkou alkalických kovov) dekarboxylát, keď sú zahrievané za vzniku oxidu:
CuCO3 - t ° = CuO + C02
Kvalitatívna reakcia - "varenie" pod pôsobením silnej kyseliny:
Na2C03 + 2HCl = 2NaCl + H20 + C02
CO3 2 + 2H + = H20 + C02
Karbid vápnika:
CaO + 3C = CaC2 + CO
CaC2 + 2 H20 = Ca (OH) 2 + C2H2.
Acetylén sa uvoľňuje, keď zinok, kadmium, lantan a karbidy céru reagujú s vodou:
2 LaC2 + 6 H20 = 2La (OH) 3 + 2C2H2 + H2.
Be 2 C a Al 4 C 3 sa rozkladajú s vodou za vzniku metánu:
Al4C3 + 12 H20 = 4A1 (OH) 3 = 3CH4.
Technika používa karbidy titánu TiC, volfrám W 2 C (tvrdé zliatiny), silikón SiC (karborundum - ako brúsny materiál a materiál pre ohrievače).
získaný vykurovaním sódy v atmosfére amoniaku a oxidu uhoľnatého:
Na2CO3 + 2NH3 + 3CO = 2NaCN + 2H20 + H2 + 2CO2
Kyselina kyanovodíková HCN - dôležitý produkt chemického priemyslu, je široko používaný v organickej syntéze. Jeho svetová produkcia dosahuje 200 tisíc ton ročne. Elektronická štruktúra kyanidového aniónu je podobná oxidu uhoľnatému (II), takéto častice sa nazývajú izoelektronické:
C = O: [: C = N:] -
Pri ťažbe zlata sa používajú kyanidy (0,1-0,2% vodný roztok):
2 Au + 4 KCN + H20 + 0,5 02 = 2 K + 2 KOH.
Keď sa vytvárajú vriace kyanidy so sírou alebo pevnými fúzmi tiokyanatany:
KCN + S = KSCN.
Pri zahrievaní kyanidov nízko aktívnych kovov sa získa dikyan: Hg (CN) 2 = Hg + (CN) 2. Roztoky kyanidu sa oxidujú na zelenomodrá:
2 KCN + O2 = 2 KOCN.
Kyselina kyanová existuje v dvoch formách:
HN = C = 0; H-O-C = N:
V roku 1828 Friedrich Wöhler (1800-1882) získal močovinu z kyanátu amónneho: NH4 OCN = CO (NH2) 2, keď sa vodný roztok odparil.
Táto udalosť sa zvyčajne považuje za víťazstvo syntetickej chémie nad "vitalistickou teóriou".
Existuje cyanický izomér - prchavej kyseliny
H-o-n = c.
Jeho soli (rrútiace ortuť Hg (ONC) 2) sa používajú v rázových zapaľovačoch.
syntéza močovina (Močovina):
CO 2 + 2 NH3 = CO (NH2) 2 + H20. Pri 130 ° C a 100 atm.
Močovina je amid kyseliny uhličitej a existuje jej "analóg dusíka", guanidín.
Najdôležitejšími anorganickými zlúčeninami uhlíka sú uhličitany (uhličitany). H2C03 je slabá kyselina (K1 = 1,3, 10-4, K2 = 5,10-11). Uhlíková vyrovnávacia pamäť podporuje bilancia oxidu uhličitého v atmosfére. Oceán má obrovskú vyrovnávaciu kapacitu, pretože ide o otvorený systém. Hlavná reakcia tlmivého roztoku je rovnováha počas disociácie kyseliny uhličitej:
H 2CO 3 ↔ H + + HCO 3 -.
S poklesom kyslosti dochádza k ďalšej absorpcii oxidu uhličitého z atmosféry pri tvorbe kyseliny:
CO 2 + H 2 O ↔ H 2 CO 3.
Pri zvyšovaní kyslosti sa rozpúšťajú uhličitanové horniny (škrupiny, kriedové a vápencové usadeniny v oceáne); kompenzuje stratu bikarbonátových iónov:
H + + C03 2- ↔ HCO3 -
CaCO 3 (TV) ↔ Ca 2+ + CO 3 2-
Tuhé uhličitany sa premieňajú na rozpustné bikarbonáty. Práve tento proces chemického rozpúšťania prebytku oxidu uhličitého pôsobí proti "skleníkovému efektu" - globálnemu otepľovaniu v dôsledku absorpcie tepelného žiarenia Zeme oxidom uhličitým. Pri výrobe skla sa používa asi tretina celosvetovej produkcie sódy (uhličitan sodný Na2CO3).
stanovenie
uhlík - šiesty prvok periodickej tabuľky. Označenie - C z latinského "karbónu". Nachádza sa v druhom období IVA. Vzťahuje sa na nekovy. Základný náboj je 6.
Uhlík sa nachádza v prírode tak vo svojom voľnom stave, ako aj vo forme mnohých zlúčenín. Voľný uhlík sa nachádza vo forme diamantu a grafitu. Okrem fosílneho uhlia sú v hlbinách zeme veľké nahromadenia oleja. V kôre sa nachádzajú vo veľkých množstvách solí kyseliny uhličitej, najmä uhličitanu vápenatého. Vo vzduchu je vždy oxid uhličitý. Nakoniec rastlinné a živočíšne organizmy sú zložené z látok, pri ktorých sa tvorí uhlík. Takže tento prvok je jedným z najbežnejších na Zemi, hoci jeho celkový obsah v kôre je len asi 0,1% (hmotnosť).
Relatívna molekulová hmotnosť látky (M r) je číslo, ktoré ukazuje, koľkokrát hmotnosť danej molekuly je viac ako 1/12 hmotnosť uhlíkového atómu a relatívna atómová hmotnosť prvku (A r) je koľkokrát priemerná hmotnosť atómov chemického prvku je viac ako 1/12 hmotnosť uhlíkového atómu.
Vzhľadom na to, že uhlík existuje vo voľnom stave vo forme monatomických molekúl C, hodnoty jeho atómovej a molekulovej hmotnosti sa zhodujú. Sú to 12.0064.
Vo voľnom stave existuje uhlík vo forme diamantu, ktorý kryštalizuje v kubickom a hexagonálnom (lonsdaleite) systéme, a grafit, ktorý patrí do šesťuholníka (obrázok 1). Uhlíkové formy, ako je drevené uhlie, koks alebo sadze, majú neusporiadanú štruktúru. Existujú tiež alotropické modifikácie získané synteticky - to sú karbonové a polykumulínové - uhlíkové odrody konštruované z lineárnych reťazcov polymérov typu -C = C- alebo = C = C =.
Obr. 1. alotropické modifikácie uhlíka.
Tiež sú známe alotropické modifikácie uhlíka, ktoré majú nasledovné názvy: grafén, fullerén, nanotrubice, nanovlákna, astralen, sklenený uhlík, kolosálne nanotrubice; amorfný uhlík, uhlíkové nanotrubičky a uhlíkové nanopóny.
V prírode existuje uhlík ako dva stabilné izotopy 12 C (98,98%) a 13 C (1,07%). Ich hmotnosť je 12 a 13. Jadro uhlíkového izotopu 12C obsahuje šesť protónov a šesť neutrónov a izotop 13C obsahuje rovnaký počet protónov a päť neutrónov.
Existuje jeden umelý (rádioaktívny) izotop uhlíka 14 cm3 s polčasom rozpadu 5730 rokov.
Na vonkajšej energetickej úrovni atómu uhlíka sú štyri elektróny, ktoré sú valenciou:
1s 2s 2 2p 2.
V dôsledku chemickej interakcie môže uhlík stratiť svoje valenčné elektróny, t.j. byť ich darcom a premeniť sa na pozitívne nabité ióny alebo prijať elektróny iného atómu, t.j. byť ich akceptorom a premeniť sa na negatívne nabité ióny:
C0-2e → C2 +;
C0-4e → C4 +;
C 0 + 4e → C 4-.
Vo voľnom stave existuje uhlík vo forme monatomických molekúl C. Predstavujeme niektoré vlastnosti, ktoré charakterizujú atóm a uhlíkovú molekulu:
Najznámejšie uhlíkové zliatiny na svete sú oceľ a liatina. Oceľ je zliatina železa s uhlíkom, ktorého obsah uhlíka nepresahuje 2%. Z liatiny (tiež zliatiny železa s uhlíkom) je obsah uhlíka vyšší - od 2 do 4%.
PRÍKLAD 1
| úloha | Aký objem oxidu uhoľnatého (IV) vynikne (NU) pri pražení 500 g vápence obsahujúceho 0,1 hmotnostného podielu nečistôt. |
| rozhodnutie | Napíšeme rovnicu reakcie horiaceho vápenca: CaCO3 = CaO + C02-. Nájdite hmotu čistého vápenca. Za týmto účelom najprv určte jeho hmotnostný podiel bez nečistôt: čistý (CaCO3) = 1 - w nečistota = 1 - 0,1 = 0,9. m číry (CaCO3) = m (CaCO3) × w čistý (CaCO3); m číry (CaCO3) = 500 × 0,9 = 450 g Vypočítajte množstvo vápencovej látky: n (CaC03) = m číry (CaC03) / M (CaC03); n (CaC03) = 450/100 = 4,5 mol. Podľa reakčnej rovnice n (CaCO3): n (C02) = 1: 1 to znamená n (CaC03) = n (C02) = 4,5 mol. Potom sa objem uvoľneného oxidu uhoľnatého (IV) rovná: V (C02) = n (C02) x Vm; V (C02) = 4,5 × 22,4 = 100,8 l. |
| Odpoveď | 100,8 l |
Príklad 2
| úloha | Koľko bude potrebný roztok obsahujúci 0,05 hmotnostného podielu alebo 5% chlorovodíka na neutralizáciu 11,2 g uhličitanu vápenatého? |
| rozhodnutie | Napíšeme reakčnú rovnicu pre neutralizáciu uhličitanu vápenatého s chlorovodíkom: CaCO3 + 2HCl = CaCl2 + H20 + C02-. Nájdite množstvo uhličitanu vápenatého: M (CaC03) = Ar (Ca) + Ar (C) + 3x Ar (O); M (CaC03) = 40 + 12 + 3 x 16 = 52 + 48 = 100 g / mol. n (CaC03) = m (CaC03) / M (CaC03); n (CaC03) = 11,2 / 100 = 0,112 mol. Podľa rovnice reakcie n (CaCO3): n (HCl) = 1: 2 to znamená n (HCI) = 2 x n (CaC03) = 2 x 0,224 mol. Určte hmotnosť látky chlorovodík obsiahnutej v roztoku: M (HCI) = Ar (H) + Ar (Cl) = 1 + 35,5 = 36,5 g / mol. m (HCl) = n (HCI) x M (HCl) = 0,224 x 36,5 = 8,176 g Vypočítajte hmotnosť roztoku chlorovodíka: m roztok (HCl) = m (HCl) x 100 / hmotn. (HCl); m roztok (HCI) = 8,176 x 100/5 = 163,52 g. |
| Odpoveď | 163,52 g |