Ako funguje elektronický predradník a jeho obvod
Ak niekto nevie, ako žiarivky fungujú, potom dôležitým bodom je elektrický prúd, ale nie v ...
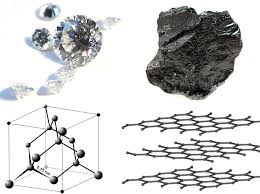
Fyzikálne vlastnosti: uhlík tvorí mnoho aloropických modifikácií: diamant - jedna z najťažších látok grafit, uhlie, sadze.
Atóm uhlíka má 6 elektrónov: 1s2 2s2 2p2 . Posledné dva elektróny sú umiestnené na samostatných p-orbitaloch a sú nepárové. V zásade by tento pár mohol obsadiť jeden orbitál, ale v tomto prípade sa elektrón-elektrónové odpudzovanie výrazne zvyšuje. Z tohto dôvodu jeden z nich trvá 2p x a druhý alebo 2p y , alebo 2p z-orbitály.
Rozdiel medzi energiou s- a p-úrovniach vonkajšej vrstvy je malý, takže atóm ľahko prechádza do excitovaného stavu, v ktorom jeden z dvoch elektrónov z 2s orbitálov prechádza do voľného priestoru. 2p. Stav valencie má konfiguráciu 1s 2 2s 1 2p x 1 2p y 1 2p z 1 . Je to tento stav atómu uhlíka, ktorý je charakteristický pre diamantovú mriežku - tetrahedrálne priestorové usporiadanie hybridných orbitálov, rovnakej dĺžky a energie väzby.
Je známe, že tento jav sa nazýva sp3 hybridizácia a výsledné funkcie sú sp3 hybrid . Tvorba štyroch väzieb sp3 poskytuje stabilnejší atóm uhlíka ako tri p-p a jedno s-s spojenie. Okrem hybridizácie sp3 na atóme uhlíka sú tiež pozorované sp2 a sp hybridizácia. . V prvom prípade dochádza k vzájomnému prekrývaniu. s- a dva p-orbitály. Vytvoria sa tri ekvivalentné sp2 - hybridné orbitály, ktoré sú umiestnené v rovnakej rovine v uhle 120 ° k sebe. Tretí orbitál p je nezmenený a smerovaný kolmo na rovinu. sp2.
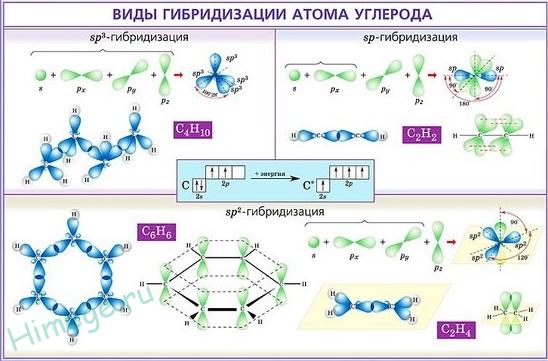
S sp hybridizáciou sa s alebo p orbitály prekrývajú. Uhol 180 ° vzniká medzi dvoma ekvivalentnými hybridnými orbitálmi, ktoré sa tvoria, pričom dva p orbitály v každom z atómov zostávajú nezmenené.
Uhlíková alotropia. Diamant a grafit
V grafitových kryštáloch sú atómy uhlíka umiestnené v paralelných rovinách, ktoré zaberajú vrcholy pravidelných šesťuholníkov. Každý z uhlíkových atómov je spojený s tromi susednými sp2 hybridnými väzbami. Spojenie medzi rovnobežnými rovinami je spôsobené van der Waalsovými silami. Voľné p-orbitály každého z atómov sú orientované kolmo na roviny kovalentných väzieb. Ich prekrývanie vysvetľuje ďalšiu π-väzbu medzi atómami uhlíka. Takže od valenčný stav, v ktorom sú atómy uhlíka v látke, závisí od vlastností tejto látky.
Najtypickejšie oxidačné stavy sú: +4, +2.
Pri nízkych teplotách je uhlík inertný, ale pri zahrievaní sa jeho aktivita zvyšuje.
- kyslíkom
C0 + 02 - t ° = oxid uhličitý CO2
s nedostatkom kyslíka - neúplné spaľovanie:
2Co + 02 - t ° = 2C + 2 Oxid uhoľnatý
- fluórom
C + 2F2 = CF4
- vodnou parou
C0 + H20 - 1200 ° = C + 2 + voda
- s oxidmi kovov. Tavený kov z rudy.
C0 + 2CuO - t ° = 2Cu + C +4 O2
- s kyselinami - oxidačné činidlá:
C0 + 2H2S04 (konc.) = C + 402 + 2SO2 + 2H20
C0 + 4HN03 (konc.) = C + 402 + 4NO2 + 2H20
- so sírou tvorí sírouhlík:
C + 2S2 = CS2.
- vytvára karbidy s niektorými kovmi
4Al + 3Co = Al4C3
Ca + 2Co = CaC2-4
- s vodíkom - metánom (ako aj s veľkým množstvom organických zlúčenín)
C0 + 2H2 = CH4
- s kremíkom tvorí karborundum (pri 2000 ° C v elektrickej peci): \\ t
Voľný uhlík sa nachádza vo forme diamantu a grafitu. Vo forme zlúčenín je uhlík v zložení minerálov: krieda, mramor, vápenec - CaCO 3, dolomit - MgCO 3 * CaCO 3; uhľovodíky - Mg (HCO 3) 2 a Ca (HCO 3) 2, CO 2 je súčasťou vzduchu; uhlík je hlavnou zložkou prírodných organických zlúčenín - plyn, ropa, uhlie, rašelina, je súčasťou organických látok, bielkovín, tukov, sacharidov, aminokyselín, ktoré tvoria živé organizmy.

Ani 4+ ióny ani C4 sa nevytvoria pri žiadnych konvenčných chemických procesoch: v zlúčeninách uhlíka sú kovalentné väzby rôznej polarity.
Oxid uhoľnatý; bezfarebný, bez zápachu, mierne rozpustný vo vode, rozpustný v organických rozpúšťadlách, toxický, t ° kip = -192 ° C; t pl. = -205 ° C.
recepcia
1) V priemysle (v generátoroch plynu):
C + 02 = C02
2) V laboratóriu - tepelným rozkladom kyseliny mravčej alebo šťaveľovej v prítomnosti H2S04 (konc.):
HCOOH = H20 + CO
H2C204 = CO + C02 + H20
Chemické vlastnosti
Za normálnych podmienok je CO inertný; pri zahrievaní - redukčné činidlo; netvoriaci oxid.
1) s kyslíkom
2C + 20 + 02 = 2C + 4O2
2) s oxidmi kovov
C + 20 + CuO = Cu + C + 402
3) s chlórom (vo svetle)
CO + Cl2 - hn = COCl2 (fosgén)
4) reaguje s alkalickými taveninami (pod tlakom)
CO + NaOH = HCOONa (mravčan sodný)
5) tvorí karbonyly s prechodnými kovmi
Ni + 4CO - t ° = Ni (CO) 4
Fe + 5CO - t ° = Fe (CO) 5
Oxid uhličitý, bezfarebný, bez zápachu, rozpustnosť vo vode - 0,9 VCO 2 sa rozpúšťa v 1 V H20 (za normálnych podmienok); ťažšie ako vzduch; t ° pl = -78,5 ° C (tuhý CO 2 sa nazýva „suchý ľad“); nepodporuje vypaľovanie.
recepcia
CaC03 - t ° = CaO + C02
CaC03 + 2HCl = CaCl2 + H20 + C02
NaHC03 + HCI = NaCl + H20 + C02
chemickývlastnostiCO2
Oxid kyseliny: reaguje so zásaditými oxidmi a zásadami za vzniku solí kyseliny uhličitej
Na20 + C02 = Na2C03
2NaOH + C02 = Na2C03 + H20
NaOH + C02 = NaHC03
Pri zvýšených teplotách môžu vykazovať oxidačné vlastnosti.
+4 +4 0 + 2Mg - t ° = 2Mg + 0 + C °
Kvalitatívna reakcia
Zakalenie vápna:
Ca (OH) 2 + C02 = CaC03 (biela zrazenina) + H20
Odtiaľ zmizne pri dlhšom prenose CO2 cez vápennú vodu nerozpustný uhličitan vápenatý ide do rozpustného hydrogenuhličitanu:
CaC03 + H20 + C02 = Ca (HCO3) 2
H2CO 3 -Kyselina je slabá, existuje iba vo vodnom roztoku:
C02 + H20-H20C03
dvojsytného:
H 2 CO 3 ↔ H + + HCO 3 - Kyslé soli - bikarbonáty, hydrogenuhličitany
HCO 3 - ↔ H + + CO 3 2- Stredné soli - uhličitany
Charakteristické sú všetky vlastnosti kyselín.
Uhličitany a hydrogenuhličitany sa môžu navzájom premieňať:
2NaHC03 - t ° = Na2C03 + H20 + C02
Na2C03 + H20 + C02 = 2NaHC03
Uhličitany kovov (okrem alkalických kovov) pri zahrievaní, dekarboxylát za vzniku oxidu: \\ t
CuC03 - t ° = CuO + C02
Kvalitatívna reakcia - „varenie“ pri pôsobení silnej kyseliny:
Na2C03 + 2HCI = 2NaCl + H20 + C02
CO3 2- + 2H + = H20 + C02
Karbid vápenatý:
CaO + 3C = CaC2 + CO
CaC2 + 2 H20 = Ca (OH) 2 + C2H2.
Acetylén sa uvoľňuje, keď karbidy zinku, kadmia, lantánu a céru reagujú s vodou:
2 LaC2 + 6H20 = 2La (OH) 3 + 2C2H2 + H2.
Be 2 C a Al4C3 sa rozloží vodou za vzniku metánu:
Al4C3 + 12H20 = 4 Al (OH) 3 = 3 CH4.
Táto technika využíva karbidy titánu TiC, volfrámu W 2 C (tvrdé zliatiny), kremíka SiC (karborundum - ako abrazíva a materiál pre ohrievače).
získané zahrievaním sódy v atmosfére amoniaku a oxidu uhoľnatého:
Na2C03 + 2 NH3 + 3CO = 2 NaCN + 2 H20 + H2 + 2C02
Kyselina kyanovodíková HCN - dôležitý produkt chemického priemyslu, sa široko používa v organickej syntéze. Jeho svetová produkcia dosahuje 200 tisíc ton ročne. Elektronická štruktúra kyanidového aniónu je podobná oxidu uhoľnatému (II), tieto častice sa nazývajú izoelektronické:
C = O: [: C = N:] -
Kyanidy (0,1 - 0,2% vodný roztok) sa používajú pri ťažbe zlata:
2 Au + 4 KCN + H20 + 0,52 = 2 K + 2 KOH.
Keď sa tvoria vriace roztoky kyanidov so sírou alebo tavnými tuhými látkami tiokyanatany:
KCN + S = KSCN.
Pri zahrievaní kyanidov z nízko aktívnych kovov sa získa dikyán: Hg (CN) 2 = Hg + (CN) 2. Kyanidové roztoky sa oxidujú na zelenomodrá:
2 KCN + 02 = 2 KOCN.
Kyselina kyánová existuje v dvoch formách:
HN = C = 0; H-O-C = N:
V roku 1828 Friedrich Wöhler (1800-1882) získal močovinu z kyanátu amónneho: NH40CN = CO (NH2) 2, keď sa vodný roztok odparil.
Táto udalosť je zvyčajne vnímaná ako víťazstvo syntetickej chémie nad "vitalistickou teóriou".
Existuje kyanický izomér - prchavá kyselina
H-o-n = c.
Jeho soli (rtúriaca ortuť Hg (ONC) 2) sa používajú v rázových zapaľovačoch.
syntéza močovina (Močovina):
C02 + 2 NH3 = CO (NH2) 2 + H20. Pri 130 ° C a 100 atm.
Močovina je amid kyseliny uhličitej a jeho „analóg dusíka“, guanidín, existuje.
Najdôležitejšie anorganické zlúčeniny uhlíka sú uhličitanové soli (uhličitany). H2C03 je slabá kyselina (K1 = 1,3.10 -4; K2 = 5,10 -11). Podporuje uhličitanový tlmivý roztok rovnováhy oxidu uhličitého v atmosfére. Oceán má obrovskú nárazníkovú kapacitu, pretože je to otvorený systém. Hlavná nárazová reakcia je rovnováha počas disociácie kyseliny uhličitej:
H2CO3: H + + HCO3 -.
S poklesom kyslosti dochádza k ďalšej absorpcii oxidu uhličitého z atmosféry s tvorbou kyseliny:
C02 + H20-H20C03.
S nárastom kyslosti sa rozpustia uhličitanové horniny (mušle, kriedové a vápencové ložiská v oceáne); toto kompenzuje stratu iónov bikarbonátu:
H + + CO 3 2- CO HCO 3 -
CaCO3 (TV) ↔ Ca 2+ + CO 3 2-
Pevné karbonáty sa premenia na rozpustné hydrogenuhličitany. Tento proces chemického rozpúšťania nadbytočného oxidu uhličitého pôsobí proti „skleníkovému efektu“ - globálnemu otepľovaniu v dôsledku absorpcie tepelného žiarenia Zeme oxidom uhličitým. Približne tretina celosvetovej výroby sódy (uhličitan sodný Na2C03) sa používa pri výrobe skla.
stanovenie
uhlík - šiesty prvok periodickej tabuľky. Označenie - C z latinského "carboneum". Nachádza sa v druhom období, skupina IVA. Vzťahuje sa na nekovy. Hlavný náboj je 6.
Uhlík sa nachádza v prírode ako vo svojom voľnom stave, tak vo forme mnohých zlúčenín. Voľný uhlík sa nachádza vo forme diamantu a grafitu. Okrem fosílneho uhlia, v hlbinách Zeme sú veľké zásoby ropy. V kôre sa nachádzajú veľké množstvá solí kyseliny uhličitej, najmä uhličitanu vápenatého. Vo vzduchu je vždy oxid uhličitý. Nakoniec sa rastlinné a živočíšne organizmy skladajú z látok, na ktorých tvorbe sa uhlík zúčastňuje. Tento prvok je teda jedným z najbežnejších na Zemi, hoci jeho celkový obsah v kôre je len asi 0,1% (hmotnosť).
Relatívna molekulová hmotnosť látky (Mr) je číslo, ktoré ukazuje, koľkokrát hmotnosť danej molekuly je viac ako 1/12 hmotnosti atómu uhlíka a relatívna atómová hmotnosť prvku (A r) je koľkokrát priemerná hmotnosť atómov chemického prvku je väčšia ako 1/12. atóm uhlíka.
Pretože uhlík existuje vo voľnom stave vo forme monatomických C molekúl, jeho atómové a molekulové hmotnostné hodnoty sa zhodujú. Sú to 12,0064.
Vo voľnom stave existuje uhlík vo forme diamantu, ktorý kryštalizuje v kubickom a hexagonálnom (lonsdaleitovom) systéme a grafite, ktorý patrí do hexagonálneho systému (obr. 1). Uhlíkové formy, ako je drevené uhlie, koks alebo sadze, majú neusporiadanú štruktúru. Synteticky sa získavajú aj allotropné modifikácie - jedná sa o karbin a polykumu - typy uhlíka, ktoré sú vyrobené z polymérov lineárneho reťazca typu -C = C– alebo = C = C =.
Obr. 1. Modifikácie alotropického uhlíka.
Známe sú aj alotropické modifikácie uhlíka, ktoré majú nasledujúce názvy: grafén, fullerén, nanotrubice, nanovlákna, astralén, sklenený uhlík, kolosálne nanotrubice; amorfný uhlík, uhlíkové nanorúrky a uhlíkové nanopenty.
V prírode uhlík existuje ako dva stabilné izotopy 12 C (98,98%) a 13 C (1,07%). Ich hmotnostné čísla sú 12 a 13. Jadro izotopu uhlíka 12C obsahuje šesť protónov a šesť neutrónov a izotop 13C obsahuje rovnaký počet protónov a päť neutrónov.
Existuje jeden umelý (rádioaktívny) izotop uhlíka 14 Cc s polčasom 5730 rokov.
Na úrovni vonkajšej energie atómu uhlíka sú štyri elektróny, ktoré sú valenčné:
1s 2 2s 2 2p 2.
V dôsledku chemickej interakcie môže uhlík stratiť svoje valenčné elektróny, t.j. sú ich donormi a premenia sa na pozitívne nabité ióny alebo prijímajú elektróny iného atómu, t. byť ich akceptorom a premenia sa na negatívne nabité ióny:
C ° -2e → C2 +;
C ° -4e → C4 +;
С 0 + 4e → С 4-.
Vo voľnom stave existuje uhlík vo forme monatomických molekúl C. Uvádzame niektoré vlastnosti, ktoré charakterizujú atóm a molekulu uhlíka:
Najznámejšie uhlíkové zliatiny na svete sú oceľ a liatina. Oceľ je zliatina železa s uhlíkom, ktorého obsah uhlíka nepresahuje 2%. V liatine (aj zliatine železa s uhlíkom) je obsah uhlíka vyšší - od 2 do 4%.
PRÍKLAD 1
| úloha | Aký objem oxidu uhoľnatého (IV) vynikne (NU) pri pražení 500 g vápenca obsahujúceho 0,1 hmotnostného podielu nečistôt. |
| rozhodnutie | Píšeme rovnicu reakcie horiaceho vápenca: CaC03 = CaO + C02-. Nájdite hmotnosť čistého vápenca. Za týmto účelom najprv zistite jeho hmotnostný zlomok bez nečistôt: číry (CaC03) = 1 - w nečistota = 1 - 0,1 = 0,9. číry (CaC03) = m (CaC03) x w (CaC03); číry (CaC03) = 500 x 0,9 = 450 g Vypočítajte množstvo vápenatej látky: n (CaC03) = m číry (CaC03) / M (CaC03); n (CaC03) = 450/100 = 4,5 mol. Podľa rovnice reakcie n (CaC03): n (C02) = 1: 1 to znamená n (CaC03) = n (C02) = 4,5 mol. Potom sa množstvo uvoľneného oxidu uhoľnatého (IV) rovná: V (C02) = n (C02) xVm; V (C02) = 4,5 x 22,4 = 100,8 l. |
| Odpoveď | 100,8 l |
PRÍKLAD 2
| úloha | Koľko bude potrebný roztok obsahujúci 0,05 hmotnostného podielu alebo 5% chlorovodíka na neutralizáciu 11,2 g uhličitanu vápenatého? |
| rozhodnutie | Reakčnú rovnicu pre neutralizáciu uhličitanu vápenatého píšeme chlorovodíkom: CaC03 + 2HCl = CaCl2 + H20 + C02-. Zistite množstvo uhličitanu vápenatého: M (CaC03) = Ar (Ca) + Ar (C) + 3 × Ar (O); M (CaC03) = 40 + 12 + 3 x 16 = 52 + 48 = 100 g / mol. n (CaC03) = m (CaC03) / M (CaC03); n (CaC03) = 11,2 / 100 = 0,112 mol. Podľa reakčnej rovnice n (CaC03): n (HCI) = 1: 2 to znamená n (HCI) = 2 x n (CaC03) = 2 x 0,224 mol. Určite hmotnosť chlorovodíka obsiahnutého v roztoku: \\ t M (HCI) = Ar (H) + Ar (Cl) = 1 + 35,5 = 36,5 g / mol. m (HCI) = n (HCI) x M (HCI) = 0,224 x 36,5 = 8,176 g Vypočítajte hmotnosť roztoku chlorovodíka: m roztok (HCI) = m (HCI) x 100 / w (HCl); m roztok (HCI) = 8,176 x 100/5 = 163,52 g. |
| Odpoveď | 163,52 g |
uhlík (Latinský karbónum), C, chemický prvok iv periodickej tabuľky, atómové číslo 6, atómová hmotnosť 12,011. Sú známe dva stabilné izotopy: 12 c (98,892%) a 13 c (1,108%). Z rádioaktívnych izotopov je najdôležitejší 14 c s polčasom rozpadu (T = 5,6? 10 3 rokov). Malé množstvá 14 s (približne 2 x 10 -10% hmotnostných) sa neustále vytvárajú v hornej atmosfére, keď neutróny kozmického žiarenia pôsobia na izotop dusíka 14 n. Špecifická aktivita izotopu 14c vo zvyškoch biogénneho pôvodu určuje ich vek. 14c je široko používaný ako .
Historické pozadie , W. známe od staroveku. Drevené uhlie bolo použité na regeneráciu kovov z rúd, diamantu - ako drahokam. Oveľa neskôr začal používať grafit na výrobu téglikov a ceruziek.
V roku 1778 K. Scheele, vykurovanie grafitu s dusičnanmi, zistil, že v tomto prípade, rovnako ako pri vykurovaní uhlia dusičnanmi, sa uvoľňuje oxid uhličitý. Chemické zloženie diamantu vzniklo ako výsledok experimentov A. Lavoisier (1772) študovať spaľovanie diamantu vo vzduchu a výskum C. Tennant (1797), ktorý dokázal, že rovnaké množstvá diamantu a uhlia dávajú počas oxidácie rovnaké množstvo oxidu uhličitého. W. bol uznaný ako chemický prvok v roku 1789 Lavoisier. Latinský názov carboneum U. dostal od carbo - uhlie.
Distribúcia v prírode. Priemerný obsah dw V zemskej kôre je 2,3? 10 - 2% hmotn. (1 - 10-2 v ultrabasickej, 1 - 10-2 - v hlavnej, 2 - 10-2 - v strede, 3 - 10-2 - - in kyslé skaly). W. sa hromadí v hornej časti zemskej kôry (biosféra): v živej hmote 18% W., drevo 50%, čierne uhlie 80%, olej 85%, antracit 96%. Významná časť U. litosféry sa koncentruje vo vápenci a dolomite.
Počet vlastných nerastov d - 112; počet organických zlúčenín W. - uhľovodíkov a ich derivátov je extrémne veľký.
Nahromadenie mnohých ďalších prvkov, ktoré sú sorbované organickou hmotou a vyzrážajú sa ako nerozpustné uhličitany atď., Je spojené s akumuláciou stravy v zemskej kôre. Co2 a kyselina uhličitá zohrávajú veľkú geochemickú úlohu v zemskej kôre. Obrovské množstvo CO 2 je emitované počas vulkanizmu - v histórii Zeme, to bol hlavný zdroj W pre biosféru.
V porovnaní s priemerným obsahom zemskej kôry ľudstvo získava mimoriadne veľké množstvá z nerastných surovín (uhlie, ropa, zemný plyn), pretože tieto minerály sú hlavným zdrojom energie.
Obeh U má veľký geochemický význam.
W. rozšírený aj vo vesmíre; na Slnku, má 4. miesto za vodíkom, héliom a kyslíkom.
Fyzikálne a chemické vlastnosti. Existujú štyri známe kryštalické modifikácie W: grafit, diamant, karbin a lonsdaleit. Grafit je šedo-čierny, nepriehľadný, mastný na dotyk, šupinatý, veľmi mäkká hmota s kovovým leskom. Vyrobené z kryštálov hexagonálnej štruktúry: a = 2,462 a, c = 6,701 a. Pri izbovej teplote a normálnom tlaku (0,1. \\ T Mn / m2, alebo 1 kgf / cm2) grafit je termodynamicky stabilný. Diamant je veľmi tvrdá kryštalická látka. Kryštály majú kubickú tvárovú stredovú mriežku: a = 3,560 a. Pri izbovej teplote a normálnom tlaku je diamant metastabilný (podrobnosti o štruktúre a vlastnostiach diamantu a grafitu nájdete v príslušných článkoch). Výrazná transformácia diamantu na grafit sa pozoruje pri teplotách nad 1400 ° C vo vákuu alebo v inertnej atmosfére. Pri atmosférickom tlaku a teplote približne 3700 ° C sublimuje grafit. Kvapalina W sa môže získať pri tlakoch nad 10,5 Mn / m2(105 kgf / cm2) a teploty nad 3700 ° C. Pre tuhé W. koks, sadze, drevené uhlie) je tiež charakterizovaný stavom s neusporiadanou štruktúrou - takzvanou "amorfnou" Y., ktorá nepredstavuje nezávislú modifikáciu; Jadrom jeho štruktúry je štruktúra kryštalického grafitu. Ohrev niektorých odrôd „amorfných“ y nad 1500–1600 ° С bez prístupu vzduchu spôsobuje ich premenu na grafit. Fyzikálne vlastnosti "amorfného" Y veľmi závisia od disperzie častíc a prítomnosti nečistôt. Hustota, tepelná kapacita, tepelná vodivosť a elektrická vodivosť "amorfného" Y. je vždy vyššia ako grafit. Carbin sa získal umelo. Je to jemný kryštalický čierny prášok (hustota 1,9-2.) g / cm3) . Vyrobené z dlhých reťazcov atómov C ležiacich navzájom paralelne. Lonsdaleit nájdený v meteoritoch a umelo získaný; jeho štruktúra a vlastnosti nie sú úplne stanovené.
Konfigurácia vonkajšieho elektrónového obalu atómu U. 2s 2 2p 2. Pre Y. charakterizovaný tvorbou štyroch kovalentných väzieb v dôsledku excitácie vonkajšieho elektrónového obalu do stavu 2 sp3. Preto je W. schopný rovnako priťahovať a darovať elektróny. Chemická väzba môže byť vykonaná sp 3 -, sp 2 -a sp- hybridné orbitály, ktoré zodpovedajú koordinačným číslam 4, 3 a 2. Počet valenčných elektrónov bunky a počet valenčných orbitálov je rovnaký; To je jeden z dôvodov stability väzby medzi atómami Y.
Jedinečná schopnosť atómov W. prepojiť sa s tvorbou silných a dlhých reťazcov a cyklov viedla k vzniku enormného množstva rôznych zlúčenín W. organickej chémie.
V zlúčeninách vykazuje W. oxidačné stavy -4; +2; 4. Atómový polomer 0,77 a, kovalentné polomery 0,77 a, 0,67 a, 0,60 a, v jednotlivých, dvojitých a trojitých väzbách; polomer iónu c 4- 2,60 a, c 4+ 0,20 a. Za normálnych podmienok je chemická chémia inertná, pri vysokých teplotách sa spája s mnohými prvkami, ktoré vykazujú silné redukčné vlastnosti. Chemická aktivita klesá v rade: „amorfný“ y, grafit, diamant; K interakcii so vzdušným kyslíkom (spaľovaním) dochádza pri teplotách nad 300 - 500 ° C, 600 - 700 ° C a 850 - 1 000 ° C pri tvorbe oxidu uhličitého co 2 a oxidu uhoľnatého.
co2 sa rozpúšťa vo vode za vzniku kyselina uhličitá. V roku 1906 O. Dielsdostal som nedostatok U. c 3 o 2. Všetky formy U sú odolné voči alkáliám a kyselinám a pomaly sa oxidujú len veľmi silnými oxidačnými činidlami (chrómová zmes, zmes koncentrovaného hno3 a kclo3 atď.). "Amorfný" W. reaguje s fluórom pri teplote miestnosti, grafitom a diamantom - pri zahrievaní. Priame spojenie W s chlórom nastáva v elektrickom oblúku; s brómom a jódom U. nereaguje, preto je mnoho halogenidy uhlíka syntetizované nepriamo. Z oxyhalogenidov všeobecného vzorca cox2 (kde X je halogén) je najznámejším cocl oxychloridom ( fosgén) . Diamant neinteraguje s diamantom; s grafitom a „amorfným“ Y. reaguje pri vysokých teplotách v prítomnosti katalyzátorov (ni, pt): pri 600–1000 ° C vzniká hlavne metán ch 4, pri 1500–2000 ° C acetylén je c 2 h 2 , V produktoch môžu byť prítomné aj iné uhľovodíky, napríklad etán c2h6 , benzén c 6 h6. Interakcia síry s "amorfným" Y a grafitom začína pri 700-800 ° C, s diamantom pri 900-1000 ° C; vo všetkých prípadoch sa tvorí sírouhlík cs 2. A kol. U zlúčeniny obsahujúce síru (tioxid, c3 s2 tiónový oxid, cos oxid siričitý a cscl2 tiofosgén) sa získajú nepriamo. Keď cs2 interaguje so sulfidmi kovov, tvoria sa tiokarbonáty - soli slabej trojuholníkovej kyseliny. Interakcia farbiva s dusíkom za vzniku cyan (cn) 2 nastáva, keď sa medzi uhlíkovými elektródami v atmosfére dusíka vedie elektrický výboj. Medzi zlúčeninami obsahujúcimi dusík majú praktický význam kyanovodík hcn a jeho početné deriváty, ako kyanidy, halogenidy, nitrily a iné, pri teplotách nad 1000 ° C dochádza k interakcii vodíka s mnohými kovmi. karbidy. Pri zahrievaní všetky formy kovu redukujú oxidy kovov za vzniku voľných kovov (zn, cd, cu, pb, atď.) Alebo karbidov (cac2, mo2c, wo, tac atď.). W. reaguje pri teplotách nad 600-800 ° C s vodnou parou a oxidom uhličitým . Charakteristickým rysom grafitu je schopnosť, pri miernom zahriatí do 300-400 ° C, interakcie s alkalickými kovmi a halogenidmi za vzniku inklúznych zlúčenín Typ c 8 me, c 24 me, c 8 x (kde X je halogén, ja je kov). Známe zlúčeniny zahŕňajú grafit s hno3, h2o4, fecl3, atď. (Napríklad grafit bisulfát c24 tak 4 h2). Všetky formy W sú nerozpustné v bežných anorganických a organických rozpúšťadlách, ale rozpúšťajú sa v niektorých roztavených kovoch (napríklad fe, ni, co).
Národný ekonomický význam Dw je determinovaný skutočnosťou, že viac ako 90% všetkých primárnych zdrojov energie spotrebovaných na svete pochádza z ekologických zdrojov. paliva, vedúca úloha, ktorá zostane v nadchádzajúcich desaťročiach, napriek intenzívnemu rozvoju jadrovej energie. Len asi 10% extrahovaného paliva sa používa ako surovina pre základná organická syntéza a petrochemická syntéza, pre získanie plasty a ďalšie
B. A. Popovkin.
W. v tele , W. - najdôležitejší prvok živín, ktorý tvorí základ života na Zemi, štrukturálnu jednotku veľkého množstva organických zlúčenín, ktoré sa podieľajú na stavbe organizmov a ich živobytiach ( biopolyméry, ako aj početné nízkomolekulárne biologicky aktívne látky - vitamíny, hormóny, mediátory atď.). Významná časť energie, ktorú organizmy potrebujú, sa vytvára v bunkách v dôsledku oxidácie W. Vznik moderného života na Zemi sa v modernej vede považuje za komplexný proces vývoja zlúčenín uhlíka. .
Jedinečná úloha diamantov v prírode je spôsobená jej vlastnosťami, ktoré spoločne nemajú žiadny iný prvok periodického systému. Medzi atómami W., rovnako ako medzi W. a inými prvkami, vznikajú silné chemické väzby, ktoré však môžu byť rozbité v relatívne miernych fyziologických podmienkach (tieto väzby môžu byť jednoduché, dvojité a trojité). W. schopnosť tvoriť 4 ekvivalentné valenčné väzby s inými atómami, W. vytvára príležitosť pre konštrukciu uhlíkových skeletov rôznych typov - lineárnych, rozvetvených, cyklických. Indikuje, že iba tri prvky - C, O a H - tvoria 98% celkovej hmotnosti živých organizmov. Tým sa dosahuje určitá nákladová efektivita v živej prírode: pri takmer neobmedzenej štrukturálnej rozmanitosti zlúčenín uhlíka môže malý počet typov chemických väzieb významne znížiť počet enzýmov potrebných na štiepenie a syntézu organických látok. Charakteristiky štruktúry atómu U. sú základom rôznych typov izoméria Organické zlúčeniny (schopnosť optickej izomérie bola rozhodujúca pre biochemický vývoj aminokyselín, sacharidov a niektorých alkaloidov).
Podľa všeobecne prijatej hypotézy A. I. Oparin, Prvé organické zlúčeniny na Zemi mali abiogénny pôvod. Zdroje W. slúžili metánu (ch 4) a kyanovodíku (hcn) obsiahnutému v primárnej atmosfére Zeme. So vznikom života je jediným zdrojom anorganického W., v dôsledku ktorého sa tvorí všetka organická hmota biosféry. oxidu uhličitého(co 2), ktorý je v atmosfére, a tiež rozpustený v prírodných vodách vo forme hco-3. Najsilnejší mechanizmus asimilácie (asimilácia) W. (vo forme co2) - fotosyntéza - prenášané všade zelenými rastlinami (približne 100 miliárd ročne sa asimiluje t co2). Na Zemi existuje evolučne starodávny spôsob asimilácie čo 2 chemosynthesis; V tomto prípade chemosyntetické mikroorganizmy nepoužívajú žiarivú energiu Slnka, ale oxidačnú energiu anorganických zlúčenín. Väčšina zvierat konzumuje dw s jedlom vo forme hotových organických zlúčenín. V závislosti od spôsobu asimilácie organických zlúčenín je zvyčajné rozlišovať autotrofné organizmy a heterotrofné organizmy. Použitie pre biosyntézu proteínov a iných živín mikroorganizmov, ktoré sa používajú ako jediný zdroj U. uhľovodíkov ropa - jeden z najdôležitejších moderných vedeckých a technických problémov.
Obsah živín v živých organizmoch z hľadiska sušiny je 34,5–40% vo vodných rastlinách a zvieratách, 45,4–46,5% v suchozemských rastlinách a zvieratách a 54% v baktériách. V procese životne dôležitej aktivity organizmov, hlavne kvôli dýchanie tkaniva oxidačný rozklad organických zlúčenín nastáva pri uvoľňovaní ko-2 do vonkajšieho prostredia. W. sa tiež uvoľňuje v zložení komplexnejších konečných produktov metabolizmu. Po smrti zvierat a rastlín sa časť W. opäť zmení na ko-2 v dôsledku hnilobného mikroorganizmu. Cirkulácia sa teda vyskytuje v prírode . Významná časť minerálnych vôd je mineralizovaná a tvorí ložiská fosílnej vody, uhlia, ropy, vápenca a pod. Okrem hlavných funkcií sa zdroj oxidu uhličitého, rozpustený v prírodných vodách av biologických tekutinách, podieľa na udržiavaní kyslosti životného prostredia, ktorá je optimálna pre životné procesy. , V zložení kakaa 3 U. tvorí vonkajšiu kostru mnohých bezstavovcov (napríklad lastúrnikov mäkkýšov) a tiež obsahuje koraly, vaječné škrupiny vtákov atď. Takéto zlúčeniny U. ako hcn, co, ccl 4, ktoré prevládali v primárnej atmosfére Zeme v prebiologických podmienkach. obdobia, ďalej v procese biologickej evolúcie, sa zmenili na silné antimetabolity metabolizmus.
Okrem stabilných izotopov W. je rádioaktívny 14c distribuovaný v prírode (obsahuje asi 0,1 v ľudskom tele curie) . Mnohé významné pokroky v štúdiu metabolizmu a cirkulácie stravy v prírode sú spojené s používaním Dw.Izotopov v biologickom a lekárskom výskume. . Použitím rádiokarbonátového štítka sa potvrdila možnosť fixácie 14 rastlín co-3 a živočíšnych tkanív, zistila sa postupnosť fotosyntetických reakcií, študovala sa výmena aminokyselín, sledovali sa cesty biosyntézy mnohých biologicky aktívnych zlúčenín atď. Použitie 14 c prispelo k úspechu molekulárnej biológie v štúdiu mechanizmov biosyntézy proteínov a prenosu dedičných informácií. Stanovenie špecifickej aktivity 14 s v organických zvyškoch obsahujúcich uhlík umožňuje posúdiť ich vek, ktorý sa používa v paleontológii a archeológii.
N. N. Chernov.
: Shafranovsky I. I., Diamonds, M. - L., 1964; Ubbelode, A.R., Lewis, F.A., Graphite a jeho kryštalické zlúčeniny, trans. S angličtinou, M., 1965; Remy G., Priebeh anorganickej chémie, trans. s ním., 1, M., 1972; Perelman AI, Geochémia prvkov v zóne hypergenézy, M., 1972; Nekrasov B.V., Fundamentals of General Chemistry, 3. vydanie, M., 1973; Akhmetov N. S., Inorganic Chemistry, 2. vyd., M., 1975; Vernadsky V.I., Eseje o geochémii, 6. vydanie, M., 1954; Roginsky S. Z., Shnol S. E., Isotopes in biochemistry, M., 1963; Obzory biochémie, trans. s angličtinou, M., 1964; Problematika evolučnej a technickej biochémie, M., 1964; Calvin M., Chemický vývoj, trans. s angličtinou, M., 1971; Loewy A., Sikewicz F., Štruktúrne a bunkové funkcie, trans. s angličtinou, 1971, Ch. 7; Biosféra, trans. od English, M., 1972.
Stiahnite si esej