حساب القوة للتيار والجهد
كما تعلمون ، يجب أن يكون للجهد الكهربائي مقياسه الخاص ، والذي يتوافق في البداية مع القيمة التي ...
C (carboneum) ، عنصر كيميائي غير معدني من المجموعة IVA (C ، Si ، Ge ، Sn ، Pb) من الجدول الدوري للعناصر. توجد في الطبيعة على شكل بلورات الماس (الشكل 1) ، أو الجرافيت أو الفوليرين وغيرها من الأشكال ، وهي جزء من العضوية (الفحم ، الزيت ، الحيوانات ، الكائنات العضوية النباتية ، إلخ) والمواد غير العضوية (الحجر الجيري ، صودا الخبز ، الخ). الكربون واسع الانتشار ، ولكن محتواه في القشرة الأرضية لا يتجاوز 0.19٪ ( انظر أيضا DIAMOND. الفلورين).
يستخدم الكربون على نطاق واسع في شكل مواد بسيطة. بالإضافة إلى الماس الثمينة ، والتي هي موضوع المجوهرات والماس الصناعي هي ذات أهمية كبيرة؟ لتصنيع أدوات الطحن والقطع. يتم استخدام الفحم وغيره من أشكال غير متبلورة من الكربون في عمليات التبييض والتنظيف وغاز الامتصاص ، في مجالات التكنولوجيا التي تتطلب فيها مواد ممتزّة ذات سطح مطور. تتميز الكربيدات ، مركبات الكربون مع المعادن ، وكذلك مع البورون والسليكون (على سبيل المثال ، Al 4 C 3 ، SiC ، B 4 C) بالصلابة العالية وتستخدم في تصنيع أدوات الكشط والقطع. الكربون هو جزء من الفولاذ وسبائك في حالة عنصري وعلى شكل كربيد. إن تشبع سطح المسبوكات الفولاذية بالكربون عند درجات الحرارة المرتفعة (التمليط) يزيد بشكل كبير من صلابة السطح ومقاومة التآكل. انظر أيضا ALLOYS.
في الطبيعة ، هناك العديد من أشكال الجرافيت المختلفة ؛ يتم الحصول على بعض مصطنع ؛ هناك أشكال غير متبلرة (على سبيل المثال ، فحم الكوك والفحم). يتم تشكيل السخام وفحم العظم ، السناج مصباح ، الأسيتيلين السخام من احتراق الهيدروكربونات مع نقص الأكسجين. ما يسمى الكربون الأبيض يتم الحصول عليها عن طريق التسامي الجرافيت الحراري تحت ضغط منخفض؟ هذه هي أصغر بلورات شفافة من أوراق الجرافيت مع حواف مدببة.
Sunyaev Z.I. كربون نفط. م ، 1980
كيمياء فرط الكربوهيدرات. م ، 1990
البحث عن "CARBON" في
4.1 أول أكسيد الكربون.
4.2 حمض الكربونيك.
الكربون هو أساس المركبات العضوية والبيولوجية العضوية والعديد من البوليمرات.
معظم مركبات الكربون هي مواد عضوية ، ولكن في هذا العمل سوف ننتبه إلى ما يسمى مركبات الكربون غير العضوية. وتشمل هذه المواد البسيطة (الجرافيت الطبيعي والماس والكاربين المشتق صناعياً) وأكاسيد الكربون وحمض الكربونيك وعدد من الأملاح التي يتكون منها حمض الكارنيك.
الكتلة الذرية النسبية للكربون هي 12.01 ، أما كثافة (الجرافيت) فهي 2.27 جم / سم 3 ،
نقطة انصهار tpl = 3370 درجة مئوية (حروق) ، نقطة الغليان tbip = 4200 درجة مئوية.
2. ملامح هيكل ذرات الكربون.
تنوع ووفرة مركبات الكربون يفسرها هيكل ذراتها. في ذرة الكربون في مداراتها الذرية الأربعة ، هناك أربعة إلكترونات. وتشارك جميع المدارات الذرية الأربعة في تشكيل الروابط الكيميائية.
على وجه الخصوص ، الجرافيت والماس هي تعديلات allotropic مع الشبكات البلورية الذرية التي تختلف في بنيتها. ومن هنا الفروق في الخواص الفيزيائية والكيميائية.
في الماس ، يتم ربط كل ذرة كربون بأربعة ذرات أخرى. في الفضاء ، توجد هذه الذرات في المركز وأركان التتراهيدرا المتصلة برؤوسها. هذه شبكة متناسقة ومتينة للغاية.
من المعروف أن الماس هو أصعب مادة في الطبيعة.
في الجرافيت ، ثلاث ذرات مترابطة ، مستلقية في نفس المستوى. لذلك ، يحدث تشكيل هذه الروابط بمشاركة ثلاث مدارات ذرية مع ثلاثة إلكترونات. كل ذرة متصلة بثلاثة أخرى موجودة في نفس الطائرة. يتم إنفاق ثلاثة AOs مع ثلاثة إلكترونات على تشكيل هذه الروابط. المدار الرابع مع إلكترون واحد هو عمودي على الطائرة. وتتداخل هذه المدارات الذرية المتبقية للشبكة بأكملها مع بعضها البعض ، لتشكل منطقة من المدارات الجزيئية. هذه المنطقة مشغولة بالنصف ، والتي توفر الجرافيت ، على النقيض من الماس ، مع الموصلية المعدنية الجيدة.
3. الخصائص الفيزيائية.
هنا ، قبل كل شيء ، بالطبع ، يجب أن نلاحظ القوة العالية لمركبات الكربون البسيطة.
طاقة الربط بين ذرات الكربون في مواد بسيطة ومعقدة ، بما في ذلك الماس والجرافيت ، عالية جداً. وقد قيل بالفعل صلابة الماس. رابطة قوية بين الذرات وشبكة الجرافيت.
على سبيل المثال ، تتجاوز قوة الشد لألياف الجرافيت بشكل كبير قوة الحديد والفولاذ التقني.
الحراريات هي خاصية فريدة أخرى من الجرافيت ، منذ ذلك الحين درجة انصهار الجرافيت تفوق 3500 درجة مئوية. في الطبيعة ، يعتبر الجرافيت المادة الأكثر مقاومة للحرارة.
يرجع التوصيل الكهربي العالي للجرافيت إلى غياب أي منتجات تفاعلية مع البيئة ، مثل أكاسيد المعادن.
بالإضافة إلى ذلك ، الجرافيت لديه القدرة على الحصول على تأثير التشحيم على فرك السطوح. ويفسر ذلك حقيقة أن ذرات الكربون في بلورة الجرافيت ترتبط ببعضها البعض في شبكات مسطحة ، وأن الرابطة بين الشبكتين ضعيفة وذات طبيعة بين الجزيئات (كما هو الحال في المواد ذات الشبكات الجزيئية). ونتيجة لذلك ، تتسبب القوى الميكانيكية الصغيرة بالفعل في تشريد الشبكات بالنسبة لبعضها البعض. هذا يسبب عمل الجرافيت بمثابة زيوت التشحيم.
4. الخواص الكيميائية للكربون ومركباته.
واحدة من الخصائص الكيميائية الرئيسية للكربون هي خصائصه الخافضة القوية. فقط في درجات الحرارة المنخفضة نسبيا ، الكربون خامل كيميائيا.
دعونا نلقي نظرة فاحصة على الخصائص الكيميائية للكربون:
الاحتراق في الأكسجين C + O 2 = CO 2 + Q؛
التفاعل مع أول أكسيد الكربون С + СО 2 = 2СО؛
الحد من المعادن من الأكاسيد 3C + Fe 2 O 3 = 3CO 2 + 4Fe.
4.1 أول أكسيد الكربون.
أول أكسيد الكربون هو نتاج الاحتراق الكامل للكربون والمواد المحتوية عليه.
في المركبات التي تحتوي على الأكسجين ، فإن الكربون ، تبعا للظروف ، يعرض قيم التكافؤ من +2 و +4.
عندما تكون درجة حرارة اللهب التقليدي أثناء احتراق المواد المحتوية على الكربون (الحطب ، الفحم ، الغاز الطبيعي ، الميثان ، الكحول ، إلخ) ، يستمر التفاعل:
C + O 2 = CO 2
من ناحية أخرى ، إذا تم إنشاء ظروف لرفع درجة الحرارة ، على سبيل المثال ، يتم تقليل المشتت الحراري (داخل طبقة سميكة من الفحم الحارق ، بما في ذلك في الفرن العالي) ، ثم تستمر التفاعلات:
C + O 2 = 2CO
CO 2 + C = 2CO
يتم تكوينه أيضًا في الحالات التالية:
أكسدة العمليات البيوكيميائية ، التنفس ، الاضمحلال ،
احتراق الميثان
CH 4 + O 2 = CO 2 + 2H 2 O
تفاعل الأحماض مع الكربونات
التحلل الحراري للكربونات وبيكربونات:
CaCO 3 = CaO + CO 2
2NaHCO 3 = Na 2 CO 3 + CO 2 + H 2 O
أول أكسيد الكربون أثقل من الهواء ، إنه غاز عديم الرائحة ولون وطعم.
1. عندما يذوب ، يتفاعل مع الماء لتشكيل حمض الكربونيك:
CO 2 + H 2 O = H 2 CO 3
2. يتفاعل مع أكاسيد كبرى:
CO 2 + CaO = CaCO 3
3. يتفاعل مع الأسباب:
CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O
4.2 حمض الكربونيك.
ضعف حمض ثنائي القاعدة ، الذي يتشكل عندما يتم إذابة أول أكسيد الكربون CO 2 في الماء.
حمض الكربونيك يعطي صفين من الأملاح:
بيكربونات قابلة للذوبان في الماء (NaHCO 3 - صودا الخبز ، Na 2 CO 3 - الصودا ، K 2 CO 3 - البوتاس) ،
غير قابلة للذوبان (MgCO 3 ، CaCO 3).
ردود فعل تشكيل الهيدروكربونات والكربونات:
CO 2 + NaOH = NaHCO 3
CO 2 + 2NaOH = Na 2 CO3 + H 2 O
يتم تحلل أملاح حمض الكربونيك.
ينحسر حمض الكربونيك من الأملاح بواسطة الأحماض القوية:
CaCO 3 + 2HCI = CaCI 2 + CO 2 + H 2 O
5. استخدام الكربون ومركباته.
في الصناعة ، غالباً ما يستخدم الكربون (الجرافيت) كزيوت تشحيم.
بالإضافة إلى ذلك ، على أساس الجرافيت ، يتم إنتاج ما يسمى بالمواد المركبة ، على وجه الخصوص ، البلاستيك الكربوني ، حيث توجد ألياف الجرافيت على مصفوفة من راتنجات الإيبوكسي.
يتم استخدام مقاومة التآكل من الجرافيت في بناء السفن.
وتستخدم هذه المواد المركبة على نطاق واسع في تكنولوجيا الطيران والفضاء. بعد كل شيء ، بالإضافة إلى القوة ، فهي خفيفة. يكفي مقارنة كثافة الجرافيت ، p = 2.3 g / cm 3 ، مع كثافة الألمنيوم "الخفيف" ، p = 2.7 جم / سم 3 ، والمزيد من الحديد ، p = 7.9 جم / سم 3 ، لاقتناع بقيمة هذا خصائص.
وبالطبع ، نعلم جميعًا أن الماس يستخدم في صناعة المجوهرات لتصنيع جميع أنواع المجوهرات ، كما أنه يستخدم على نطاق واسع في العديد من الصناعات ، حيث يتم استخدام ممتلكاتهم ذات القوة العالية.
مذكرة تفاهم "Nikiforovskaya Secondary Secondary School №1"
الكربون ومركباته غير العضوية الرئيسية
ملخص
الانتهاء: فئة الطالب 9V
سيدوروف الكسندر
المدرس: Sakharova L.N.
دميترييفكا 2009
مقدمة
الفصل الأول. كل شيء عن الكربون
1.1. الكربون في الطبيعة
1.2. تعديلات التألق الكربون
1.3. الخصائص الكيميائية للكربون
1.4. استخدام الكربون
الفصل الثاني مركبات الكربون غير العضوية
استنتاج
أدب
مقدمة
الكربون (lat. Carboneum) C عنصر كيميائي في المجموعة الرابعة من النظام الدوري: العدد الذري 6 ، الكتلة الذرية 12011 (1). النظر في بنية ذرة الكربون. في مستوى الطاقة الخارجي لذرة الكربون أربعة إلكترونات. ارسم بيانيًا:
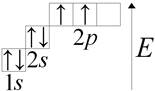
من المعروف أن الكربون منذ العصور القديمة ، واسم مكتشف هذا العنصر غير معروف.
في نهاية القرن السابع عشر. حاول علماء فلورنسا Averani و Tardzhoni دمج عدة ماس صغيرة في واحدة كبيرة وتسخينها بمساعدة زجاج حارق من أشعة الشمس. اختفى الماس واحترق في الهواء. في عام 1772 ، أظهر الكيميائي الفرنسي أ. لافوازييه أن ثاني أكسيد الكربون يتكون أثناء احتراق الماس. فقط في عام 1797 ، أثبت العالم الإنجليزي S. Tennant هوية طبيعة الجرافيت والفحم. بعد احتراق كميات متساوية من الفحم والماس ، تبين أن أحجام أول أكسيد الكربون (4) هي نفسها.
إن تنوع مركبات الكربون ، بسبب قدرة ذراتها على التزاوج مع بعضها البعض وبين ذرات العناصر الأخرى بطرق مختلفة ، يحدد الموقع الخاص للكربون بين العناصر الأخرى.
رئيس أنا . كل شيء عن الكربون
1.1. الكربون في الطبيعة
يوجد الكربون في الطبيعة ، سواء في الحالة الحرة أو في شكل مركبات.
يتم العثور على الكربون الحر في شكل الماس والجرافيت وكاربون.
الماس نادرة جدا. تم العثور على أكبر الماس المعروف ، كولينان ، في جنوب أفريقيا في عام 1905 ، وزنها 621.2 غرام ، وقياس 10 × 6.5 × 5 سم.واحد من أكبر وأجمل الماس يتم تخزينها في صندوق الماس في موسكو. العالم - "النسور" (37.92 جم).
حصلت الماس على اسمها من اليونانية. "أداماس" - لا يقهر ، غير قابل للتدمير. تقع أهم رواسب الماس في جنوب أفريقيا والبرازيل وياكوتيا.
توجد رواسب كبيرة من الغرافيت في ألمانيا ، في سريلانكا ، في سيبيريا ، في ألتاي.
المعادن الرئيسية التي تحتوي على الكربون هي: مغنسيت MgCO 3 ، الكالسيت (الجير العنبر ، الحجر الجيري ، الرخام ، الطباشير) CaCO 3 ، دولوميت CaMg (CO 3) 2 ، إلخ.
جميع المعادن القابلة للاشتعال - النفط ، الغاز ، الخث ، الحجر والفحم البني ، الصخر الزيتي - مبنية على أساس كربوني. بعض الفحم الأحفوري الذي يحتوي على ما يصل إلى 99٪ C قريب من التكوين إلى الكربون.
يمثل الكربون نسبة 0.1٪ من قشرة الأرض.
في شكل أول أكسيد الكربون (رابعا) الكربون CO 2 هو عنصر من عناصر الغلاف الجوي. يتم إذابة كمية كبيرة من ثاني أكسيد الكربون في الغلاف المائي.
1.2. تعديلات التألق الكربون
يشكل الكربون العنصري ثلاثة تعديلات مؤثرات: الماس ، الجرافيت ، الكاربن.
1. الماس - مادة بلورية عديمة اللون وشفافة ، تنكس بشدة أشعة الضوء بشدة. تكون ذرات الكربون في الماس في حالة تهجين sp 3. في الحالة المثارة ، يحدث تبخر إلكترونات التكافؤ في ذرات الكربون وتشكيل أربعة إلكترونات غير مقترحة. عندما تتشكل الروابط الكيميائية ، تكتسب سحب الإلكترون نفس الشكل المطول ويتم ترتيبها في الفضاء بحيث يتم توجيه محاورها إلى رؤوس الذرات رباعي الأسطح. عندما تتداخل قمم هذه الغيوم مع غيوم ذرات كربون أخرى ، تنشأ روابط تساهمية بزاوية 109 ° 28 "، وتتكون خاصية الكريستال البلورية للماس.
تحيط كل ذرة كربون في ماسة بأربعة ذرات أخرى ، وتقع في اتجاهات من مركز التتراهدرا إلى قمم. المسافة بين الذرات في رباعي الأسطح هي 0.154 نانومتر. قوة كل السندات هي نفسها. وهكذا ، فإن الذرات الموجودة في الماس "معبأة" بإحكام شديد. عند 20 درجة مئوية ، تكون كثافة الماس 3.515 جم / سم 3. هذا يفسر صلابة استثنائية. الماس يجري التيار الكهربائي بشكل سيئ.
في عام 1961 ، بدأ الاتحاد السوفياتي في الإنتاج الصناعي للماس الاصطناعي من الجرافيت.
في التوليف الصناعي للماس استخدم الضغط في الآلاف من MPa ودرجات الحرارة من 1500 إلى 3000 درجة مئوية. تتم العملية في وجود محفزات ، والتي يمكن أن تخدم بعض المعادن ، على سبيل المثال ني. الجزء الأكبر من الألماس المشكل هو بلورات صغيرة وغبار الماس.
عند تسخينها دون الوصول إلى الهواء فوق 1000 درجة مئوية ، يتحول الماس إلى الجرافيت. عند 1750 درجة مئوية ، يحدث تحويل الماس إلى الجرافيت بسرعة.
هيكل الماس
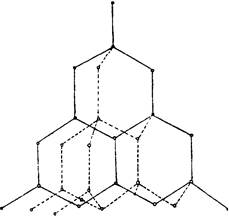
2. الجرافيت عبارة عن مادة بلورية رمادية سوداء ذات بريق معدني ، زيتي على اللمس ، أقل صلابة في الورقة.
تكون ذرات الكربون في بلورات الجرافيت في حالة تهجين sp 2: يشكل كل منهما ثلاثة روابط تساهمية مع ذرات مجاورة. الزوايا بين اتجاهات الرابطة هي 120 درجة. والنتيجة هي شبكة تتكون من سداسيات منتظمة. المسافة بين نوى ذرات الكربون المتجاورة داخل الطبقة هي 0.142 نانومتر. يشغل الإلكترون الرابع للطبقة الخارجية لكل ذرة كربون في الجرافيت بواسطة مدارات p- غير مشارك في التهجين.
يتم توجيه السحب الإلكترونية غير الهجينة من ذرات الكربون بشكل متعامد على مستوى الطبقة المتداخلة ، وتتداخل مع بعضها البعض ، وتشكل روابط del غير محددة. الطبقات المجاورة في بلورة الجرافيت هي 0.335 نانومتر منفصلة ومترابطة بشكل ضعيف ، بشكل رئيسي من قبل قوات فان دير فالس. لذلك ، يحتوي الجرافيت على قوة ميكانيكية منخفضة وينقسم بسهولة إلى مقاييس ، وهي دائمًا شديدة التحمل. الرابطة بين طبقات الكربون في الجرافيت معدنية جزئيا. هذا يفسر حقيقة أن الجرافيت يدير الكهرباء بشكل جيد ، ولكن لا يزال غير جيد مثل المعادن.

هيكل الجرافيت
تختلف الخصائص الفيزيائية في الجرافيت تباينًا كبيرًا في الاتجاهات - متعامدة ومتوازية مع طبقات ذرات الكربون.
عند التسخين بدون هواء ، لا يخضع الجرافيت لأية تغييرات تصل إلى 3700 درجة مئوية. في درجة الحرارة هذه ، يتصاعد ، لا يذوب.
يتم الحصول على الجرافيت الاصطناعي من أفضل درجات الفحم عند 3000 درجة مئوية في الأفران الكهربائية دون الوصول إلى الهواء.
يتميز الجرافيت بالثبات الديناميكي الحراري على نطاق واسع من درجات الحرارة والضغوط ، وبالتالي ، فهو مقبول كحالة قياسية للكربون. كثافة الجرافيت هي 2.265 جم / سم 3.
3. كاربين - مسحوق أسود ناعم الحبيبات. في تركيبها البلوري ، ترتبط ذرات الكربون بتناوب روابط مفردة وثلاثية في السلاسل الطولية:
−С≡С - С≡С - С≡С–
تم الحصول على هذه المادة لأول مرة بواسطة V.V. كورشاكوم ، إيه إم. سلادكوف ، في. آي. Kasatochkin، Yu.P. Kudryavtsevym في أوائل الستينات من القرن العشرين.
في وقت لاحق ، تبين أن الكربن يمكن أن يوجد في أشكال مختلفة ويحتوي على كل من سلاسل polyacetylene و polycumylene التي ترتبط فيها ذرات الكربون بواسطة روابط مزدوجة:
C = C = C = C = C = C =
تم العثور على كاربين في وقت لاحق في الطبيعة - في مادة النيزك.
كاربين لديه خصائص أشباه الموصلات ، في إطار عمل الضوء ، يزيد من الموصلية بشكل كبير. بسبب وجود أنواع مختلفة من الروابط وطرق مختلفة لوضع سلاسل ذرات الكربون في الشبكة البلورية ، يمكن أن تختلف الخواص الفيزيائية ل carbyne بشكل كبير. عند تسخينها دون الوصول إلى الهواء فوق 2000 درجة مئوية ، يكون الكاربين مستقرًا ؛ وعند درجات حرارة تبلغ حوالي 2300 درجة مئوية ، يتم ملاحظة انتقالها إلى الجرافيت.
يتكون الكربون الطبيعي من نظيرين
(98.892٪) و (1.108٪). وبالإضافة إلى ذلك ، توجد في الغلاف الجوي شوائب طفيفة من نظائر مشعة ، يتم الحصول عليها بوسائل اصطناعية.كان يعتقد سابقاً أن الفحم النباتي والسخام وفحم الكوك مشابهان في التركيب إلى الكربون النقي ويختلفان في الخواص من الألماس والجرافيت ، ويمثلان تحويلاً مستقلاً لتضليل الكربون ("غير متبلور الكربون"). ومع ذلك ، فقد وجد أن هذه المواد تتكون من أصغر الجسيمات البلورية التي ترتبط فيها ذرات الكربون بنفس الطريقة كما في الجرافيت.
4. الفحم - الجرافيت الأرض ناعما. يتشكل خلال التحلل الحراري للمركبات المحتوية على الكربون دون الوصول إلى الهواء. الفحم تختلف اختلافا كبيرا في الخصائص اعتمادا على المادة التي يتم الحصول عليها منها وطريقة الإنتاج. أنها تحتوي دائما على الشوائب التي تؤثر على ممتلكاتهم. أهم أنواع الفحم هي الفحم ، الفحم ، والسخام.
يتم الحصول على فحم الكوك بتسخين الفحم دون وصول الهواء.
يتم تشكيل الفحم عندما يتم تسخين الخشب بدون هواء.
السخام هو مسحوق جرافيت بلوري ناعم جدا. يتكون من احتراق الهيدروكربونات (الغاز الطبيعي ، الأسيتيلين ، التربنتين ، إلخ) مع وصول محدود للهواء.
الكاربونات النشطة هي الممتزات الصناعية المسامية التي تتكون أساسا من الكربون. يشير الامتصاص إلى الامتصاص عن طريق سطح المواد الصلبة للغازات والمذيبات. يتم الحصول على الكربون النشط من الوقود الصلب (الجفت ، الفحم البني والأسود ، أنثراسايت) ، الخشب ومنتجاته (الفحم ، النشارة ، النفايات الورقية) ، نفايات صناعة الجلود ، مواد ذات أصل حيواني ، مثل العظام. الجمر يختلف في المتانة الميكانيكية العالية ، وجعل من قذيفة من جوز الهند وغيرها من المكسرات ، من الحجارة من الفواكه. يتم تمثيل هيكل الفحم بمسام من جميع الأحجام ، ومع ذلك ، يتم تحديد سعة الامتزاز ومعدل الامتزاز بواسطة محتوى micropores لكل وحدة كتلة أو حجم الحبيبات. في إنتاج الفحم النشط ، يتم أولاً تعريض المادة الأولية للمعالجة الحرارية بدون هواء ، ونتيجة لذلك يتم إزالة الرطوبة وجزء منها. هذا يشكل بنية مسامية كبيرة من الفحم. للحصول على هيكل مجهّز microporous ، يتم التنشيط إما عن طريق الغاز أو أكسدة البخار أو عن طريق المعالجة باستخدام الكواشف الكيميائية.
1.3. الخصائص الكيميائية للكربون
في درجات الحرارة العادية ، يكون الماس ، والجرافيت ، والفحم خاملًا كيميائياً ، ولكن عند درجات حرارة عالية يزيد نشاطهم. على النحو التالي من هيكل الأشكال الرئيسية للكربون ، يتفاعل الفحم بسهولة أكبر من الجرافيت وخصوصًا الألماس. الجرافيت ليس فقط أكثر تفاعلاً من الماس ، ولكن ، من خلال التفاعل مع مواد معينة ، يمكنه تشكيل منتجات لا تتشكل منها.
1. كعامل مؤكسد ، يتفاعل الكربون مع بعض المعادن في درجات حرارة عالية ، وتشكيل الكربيد:
CS + 4Al = Al 4 C 3 (كربيد الألومنيوم).
2. مع الهيدروجين والفحم والجرافيت شكل الهيدروكربونات. يمكن الحصول على أبسط ممثل - الميثان CH 4 - في وجود محفز Ni بدرجة حرارة عالية (600-1000 ° درجة مئوية):
CH 4.3. عند التفاعل مع الأكسجين ، فإن الكربون يحد من الخواص. مع احتراق الكربون الكامل لأي تعديل مؤثر ، يتم تشكيل أول أكسيد الكربون (IV):
C + O 2 = CO 2.
الاحتراق غير الكامل ينتج أول أكسيد الكربون (II) CO:
C + O 2 = 2SO.
كلا ردود الفعل هي طاردة للحرارة.
4. تتجلى خواص الفحم بشكل خاص عند التفاعل مع أكاسيد المعادن (الزنك ، النحاس ، الرصاص ، الخ) ، على سبيل المثال:
C + 2CuO = CO 2 + 2Cu ،
С + 2ZnO = СО 2 + 2Zn.
تعتمد هذه التفاعلات على أهم عملية تعدين - صهر المعادن من الخامات.
في حالات أخرى ، على سبيل المثال ، عند التفاعل مع أكسيد الكالسيوم ، يتم تشكيل الكربيد:
CaO + ZS = CaC 2 + CO.
5. يتأكسد الفحم بواسطة الأحماض الكبريتيه و حامض النيتريك المركز:
C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O ،
ЗС + 4НNО 3 = ЗСО 2 + 4NO + 2Н 2 O.
أي شكل من أشكال الكربون مقاومة للقلويات!
1.4. استخدام الكربون
تستخدم الماس لمعالجة المواد الصلبة المختلفة ، لقطع ، طحن ، حفر ونقش الزجاج ، لصخور الحفر. بعد الطحن والقطع ، يتم تحويل الماس إلى الماس المستخدم في المجوهرات.
الجرافيت هو المادة الأكثر قيمة للصناعة الحديثة. تصنع قوالب الصب ، بوتقة الانصهار وغيرها من المنتجات الحرارية من الجرافيت. بسبب ثباته الكيميائي العالي ، يستخدم الجرافيت في تصنيع الأنابيب والأجهزة المبطنة بطبقات من الغرافيت من الداخل. يتم استخدام كميات كبيرة من الجرافيت في الصناعة الكهربائية ، على سبيل المثال ، في تصنيع الأقطاب الكهربائية. يستخدم الجرافيت لتصنيع أقلام الرصاص وبعض الدهانات ، مثل زيوت التشحيم. يستخدم الجرافيت النقي جدا في المفاعلات النووية لإبطاء النيوترونات.
يجذب بوليمر الكربون الخطي - كاربين - انتباه العلماء باعتباره مادة واعدة لصناعة أشباه الموصلات ، والتي يمكن أن تعمل في درجات حرارة عالية ، وألياف قوية للغاية.
يستخدم الفحم في الصناعة المعدنية ، في الحدادة.
يستخدم كوكاكولا كعامل مختزل في صهر المعادن من الخامات.
يستخدم السوث كملء مطاطي لزيادة القوة ، لذلك تكون إطارات السيارات سوداء. كما يستخدم السخام كمكون من أحبار الطباعة ، الماسكارا ، تلميع الأحذية.
يتم استخدام الكربون النشط لتنظيف واستخراج وفصل المواد المختلفة. وتستخدم الكاربونات النشطة كمواد مالئة للأقنعة الواقية من الغازات وكمواد ماصة في الطب.
رئيس II . مركبات الكربون غير العضوية
يتكون الكربون من أكاسيد - أول أكسيد الكربون (II) أول أكسيد الكربون وأول أكسيد الكربون (IV) CO 2.
أول أكسيد الكربون (II) أول أكسيد الكربون هو غاز عديم اللون والرائحة وقابل للذوبان في الماء بشكل سيئ. يطلق عليه أول أكسيد الكربون ، لأنه سام جدا. عند التنفس في الدم ، فإنه يدمج بسرعة مع الهيموجلوبين ، مما يشكل مركب كربوكسي هيموجلوبين مركب ، وبالتالي يحرم الهيموجلوبين من القدرة على حمل الأكسجين.
عندما يتنفس هواء يحتوي على 0.1٪ CO ، قد يفقد الشخص الوعي ويموت فجأة. يتم تشكيل أول أكسيد الكربون أثناء الاحتراق غير الكامل للوقود ، وهذا هو السبب في أنه خطير للغاية لإغلاق المداخن قبل الأوان.
يُعزى أول أكسيد الكربون (II) ، كما تعرف بالفعل ، إلى أكاسيد غير ملحقة ، لأنه ، كإكسيد غير فلزي ، يجب أن يتفاعل مع القلويات والأكاسيد الأساسية لتكوين الملح والماء ، ولكن هذا لا يلاحظ.
2CO + O 2 = 2CO 2.
أول أكسيد الكربون (II) قادر على أخذ الأوكسجين من أكاسيد المعادن ، أي لاستعادة المعادن من أكاسيدها.
Fe 2 O 3 + SOA = 2Fe + SOA 2.
هذه الخاصية من أول أكسيد الكربون (الثاني) المستخدمة في تعدين في صهر الحديد.
أول أكسيد الكربون (IV) CO 2 - المعروف باسم ثاني أكسيد الكربون - هو غاز عديم اللون والرائحة. إنه حوالي واحد ونصف المرة أثقل من الهواء. في الظروف العادية ، يذوب حجم واحد من ثاني أكسيد الكربون في حجم واحد من الماء.
مع ضغط يبلغ حوالي 60 ضغط جوي ، يتحول ثاني أكسيد الكربون إلى سائل عديم اللون. عندما يتبخر ثاني أكسيد الكربون السائل ، يتحول جزء منه إلى كتلة صلبة تشبه الثلوج ، والتي يتم ضغطها في الصناعة - وهذا هو "الثلج الجاف" المعروف لك ، والذي يستخدم لتخزين الطعام. أنت تعرف بالفعل أن ثاني أكسيد الكربون الصلب لديه شعرية جزيئية ، قادرة على التسامي.
ثاني أكسيد الكربون CO 2 هو أكسيد حامض نموذجي: يتفاعل مع القلويات (على سبيل المثال ، يتسبب في ماء الجير العكر) ، مع أكاسيد أساسية وماء.
لا يحرق ولا يحافظ على الاحتراق ، وبالتالي يستخدم لإطفاء الحرائق. ومع ذلك ، لا يزال المغنيسيوم يحرق في ثاني أكسيد الكربون لتشكيل أكسيد وإطلاق الكربون في شكل السخام.
CO 2 + 2Mg = 2MgO + C.
يتم الحصول على ثاني أكسيد الكربون من خلال العمل على أملاح حمض الكربونيك - الكربونات مع حلول حمض الهيدروكلوريك ، النيتريك ، وحتى الأحماض الخل. في المختبر ، يتم إنتاج ثاني أكسيد الكربون من خلال عمل حمض الهيدروكلوريك على الطباشير أو الرخام.
CaCO 3 + 2HCl = CaCl 2 + H 2 0 + C0 2.
في الصناعة ، يتم الحصول على ثاني أكسيد الكربون عن طريق حرق الحجر الجيري:
CaCO 3 = CaO + C 2.
كما يستخدم ثاني أكسيد الكربون ، بالإضافة إلى التطبيق المذكور بالفعل ، لإنتاج مشروبات فوارة وإنتاج الصودا.
عندما يتم إذابة أكسيد الكربون (IV) في الماء ، يتم تكوين حمض الكربونيك H2 CO 3 ، وهو غير مستقر للغاية ويتحلل بسهولة في مكوناته الأولية - ثاني أكسيد الكربون والماء.
كحمض ثنائي الباسيك ، يشكل حمض الكربونيك صفين من الأملاح: متوسطة - كربونات ، على سبيل المثال ، CaCO 3 ، وبيكربونات حمضية ، على سبيل المثال ، Ca (HCO 3) 2. من الكربونات في الماء ، الأملاح القابلة للذوبان فقط من البوتاسيوم والصوديوم والأمونيوم. والأملاح الحمضية قابلة للذوبان بصفة عامة في الماء.
بوجود فائض من ثاني أكسيد الكربون في وجود الماء ، يمكن تحويل الكربونات إلى بيكربونات. لذا ، إذا تم تمرير ثاني أكسيد الكربون عبر ماء الجير ، فإنه سيصبح غائما في البداية بسبب كربونات الكالسيوم غير القابلة للذوبان في الماء ، ولكن مع مرور ثاني أكسيد الكربون ، تختفي التعكر نتيجة لتشكيل بيكربونات الكالسيوم القابلة للذوبان:
CACO 3 + H 2 O + СO 2 = Са (НСО 3) 2.
هذا هو وجود هذا الملح الذي يفسر الصلابة المؤقتة للمياه. لماذا مؤقت؟ لأنه عند تسخين ، يتم تحويل ثاني كربونات الكالسيوم القابل للذوبان مرة أخرى إلى كربونات غير قابلة للذوبان:
Ca (НСО 3) 2 = СаСO 3 ↓ + Н 2 0 + С0 2.
هذا التفاعل يؤدي إلى تشكيل حثالة على جدران الغلايات وأنابيب التدفئة بالبخار والغلايات المحلية ، وفي الطبيعة نتيجة لهذا التفاعل ، يتم تعليق الهوابط الرملية الغريبة المتدلية من الكهوف ، والتي تنمو فيها الصواعد من الأسفل.
الأملاح الأخرى من الكالسيوم والمغنيسيوم ، وخاصة الكلوريدات والكبريتات ، تعطي الماء صلابة ثابتة. غليان صلابة دائمة من الماء لا يمكن القضاء عليها. علينا أن نستخدم كربونات - صودا أخرى.
Na 2 CO 3 ، التي تحول هذه الأيونات Ca + + إلى الرواسب ، على سبيل المثال:
L 2 + Na 2 CO 3 = CaCO 3 ↓ + 2NaCl.
يمكن أيضًا استخدام الصودا لإزالة صلابة المياه المؤقتة.
يمكن الكشف عن الكربونات والبيكربونات باستخدام المحاليل الحمضية: عند تعرضها للأحماض ، يتم ملاحظة خاصية "الغليان" بسبب ثاني أكسيد الكربون المحرّر.
هذا التفاعل هو رد فعل نوعي لأملاح حمض الكربونيك.
استنتاج
تستند جميع الحياة الأرضية على الكربون. كل جزيء كائن حي يبنى على أساس هيكل الكربون. تهاجر ذرات الكربون باستمرار من جزء واحد من المحيط الحيوي (الغلاف الضيق للأرض ، حيث توجد الحياة) إلى آخر. باستخدام دورة الكربون في الطبيعة كمثال ، يمكننا تتبع صورة الحياة على كوكبنا في ديناميات.
احتياطيات الكربون الرئيسية على الأرض هي في شكل ثاني أكسيد الكربون في الغلاف الجوي وتذوب في المحيطات ، أي ثاني أكسيد الكربون (CO 2). فكر أولاً في جزيئات ثاني أكسيد الكربون في الغلاف الجوي. تمتص النباتات هذه الجزيئات ، ثم في عملية التمثيل الضوئي ، يتم تحويل ذرة الكربون إلى مجموعة متنوعة من المركبات العضوية ، وبالتالي يتم دمجها في بنية النباتات. علاوة على ذلك ، هناك العديد من الخيارات:
1. يمكن أن يبقى الكربون في النباتات حتى تموت النباتات. بعد ذلك ، ستدخل جزيئاتها في الغذاء إلى المحللات (الكائنات الحية التي تتغذى على المادة العضوية الميتة وفي نفس الوقت تدمرها إلى مركبات غير عضوية بسيطة) ، مثل الفطريات والنمل الأبيض. في نهاية المطاف ، سيعود الكربون إلى الغلاف الجوي باسم ثاني أكسيد الكربون.
2. يمكن أن تؤكل النباتات من العواشب. في هذه الحالة ، فإن الكربون إما يعود إلى الغلاف الجوي (في عملية التنفس الحيوانات وعندما تتحلل بعد الموت) ، أو الحيوانات آكلة اللحوم سوف تؤكل من قبل الحيوانات آكلة اللحوم (ومن ثم يعود الكربون مرة أخرى إلى الغلاف الجوي بنفس الطرق) ؛
3. يمكن أن يموت النباتات وينتهي تحت الأرض. ثم في النهاية سيتحولون إلى وقود أحفوري - على سبيل المثال ، الفحم.
في حالة انحلال جزيء CO 2 الأصلي في مياه البحر ، هناك عدة خيارات ممكنة أيضًا:
يمكن أن يعود ثاني أكسيد الكربون ببساطة إلى الغلاف الجوي (يحدث هذا النوع من تبادل الغازات المتبادلة بين المحيطات والغلاف الجوي طوال الوقت) ؛
يمكن للكربون دخول أنسجة النباتات أو الحيوانات البحرية. ثم يتراكم تدريجيا في شكل رواسب في قاع المحيطات ويتحول في النهاية إلى حجر جيري أو من الرواسب سيتحول مرة أخرى إلى ماء بحر.
إذا كان الكربون جزءًا من الرواسب أو الوقود الأحفوري ، يتم إزالته من الغلاف الجوي. أثناء وجود الأرض ، تم استبدال الكربون الذي تمت إزالته بهذه الطريقة بثاني أكسيد الكربون ، والذي تم إطلاقه في الغلاف الجوي أثناء الثورات البركانية وعمليات الحرارة الجوفية الأخرى. في الظروف الحديثة ، تضاف أيضًا الانبعاثات الناتجة عن احتراق الوقود الأحفوري البشري إلى هذه العوامل الطبيعية. نتيجة لتأثير ثاني أكسيد الكربون على تأثير الاحتباس الحراري ، أصبحت دراسة دورة الكربون مهمة مهمة للعلماء الذين يدرسون الغلاف الجوي.
جزء من هذا البحث هو تحديد كمية ثاني أكسيد الكربون الموجودة في الأنسجة النباتية (على سبيل المثال ، في غابة مزروعة حديثًا) - يطلق عليها العلماء اسم بالوعة الكربون. وبما أن حكومات الدول المختلفة تحاول التوصل إلى اتفاقية دولية للحد من انبعاثات ثاني أكسيد الكربون ، فإن قضية نسبة متوازنة من البواليع وانبعاثات الكربون في الدول الفردية قد أصبحت نقطة خلاف رئيسية بالنسبة للدول الصناعية. ومع ذلك ، يشك العلماء في أنه لا يمكن وقف تراكم ثاني أكسيد الكربون في الغلاف الجوي إلا عن طريق المزارع.
ينتشر الكربون باستمرار في المحيط الحيوي الأرضي من خلال مسارات مترابطة مغلقة. حاليا ، تضاف آثار حرق الوقود الأحفوري إلى العمليات الطبيعية.
المراجع:
1. أخميتوف إن. الكيمياء الصف 9: الدراسات. للتعليم العام. بروك. المؤسسات. - الطبعة الثانية. - M:: Education، 1999. - 175 p .: Il.
2. غابريليان الولايات المتحدة الكيمياء الصف 9: الدراسات. للتعليم العام. بروك. المؤسسات. - الطبعة الرابعة. - M: Drofa، 2001. - 224 pp.، Ill.
3. غابريليان او.سي. درجات الكيمياء 8-9: الطريقة. بدل. - الطبعة الرابعة. - M: Drofa، 2001. - 128 p.
4. Eroshin D.P.، Shishkin E.A. طرق حل المشكلات في الكيمياء: الدراسات. بدل. - M: التنوير ، 1989. - 176 ص. ، سوء.
5. كريمنشوك M. كيمياء: كتيب الطالب. - م.: فيول. مجتمع "WORD": Izd-vo AST، LLC، 2001. - 478 p.
6. Kritsman V.A. كتاب لقراءة الكيمياء غير العضوية. - م: التنوير ، 1986. - 273 ص.