Розрахунок потужності по струму і напрузі
Як відомо у електричної напруги повинна бути своя міра, яка спочатку відповідає тій величині, що ...
Вуглець.
Вуглець (Carboneum), С - хімічний елемент IV групи, побічної підгрупи, 2-го періоду періодичної системи Д. І. Менделєєва, порядковий номер 6. Відносна атомна маса: 12,011. Електронегативність: 2,6. Температура плавлення: 3370єС (згоряє). Температура кипіння: 4200єС. Щільність (графіт): 2,27 г / смі. Число власних мінералів вуглецю - 112; виключно велике число органічних сполук вуглецю - вуглеводнів та їх похідних. Вуглець знаходиться в природі як у вільному стані (у вигляді алмазу, графіту), так і у вигляді сполук (міститься в горючих сланцях, буром і кам'яному вугіллі, торфі і у вигляді сполук у нафті, природних горючих газах, в карбонатах). Всі живі організми побудовані з сполук вуглецю. Карбон широко поширений, але зміст його в земній корі всього 0,19%; також вуглець широко поширений в космосі; на Сонці він займає 4-е місце після водню, гелію і кисню. У порівнянні з середнім вмістом в земній корі людство у виключно великих кількостях витягує карбон з надр (вугілля, нафта, природний газ), так як ці копалини - основне джерело енергії.
Історична довідка. У 1778 К. Шеєле, нагріваючи графіт з селітрою, виявив, що при цьому, як і при нагріванні вугілля з селітрою, виділяється вуглекислий газ. Хімічний склад алмаза був встановлений в результаті дослідів А. Лавуазьє (1772) з вивчення горіння алмаза на повітрі і досліджень С. Теннанта (1797), який довів, що однакові кількості алмаза і вугілля дають при окисленні рівні кількості вуглекислого газу. Вуглець був визнаний хімічним елементом в 1789 Лавуазьє. Латинська назва "carboneum" карбон отримав від "carbo" - вугілля. А в 1961 Міжнародні союзи теоретичної і прикладної хімії (ІЮПАК) і з фізики взяли за одиницю атомної маси масу ізотопу вуглецю 12C, скасувавши що існувала до того кисневу шкалу атомних мас. Атомна маса вуглецю в цій системі дорівнює 12,011, так як вона є середньою для трьох природних ізотопів вуглецю з урахуванням їх поширеності в природі.
Вуглець відомий з давніх-давен. З давніх-давен відомо, що графітом можна маркувати інший матеріал, і сама назва «графіт», що походить від грецького слова, що означає «писати», запропоновано А.Вернера в 1789. Однак історія графіту заплутана, часто за нього брали речовини, що володіють подібними зовнішніми фізичними властивостями , наприклад молибденит (сульфід молібдену), у свій час вважався графітом. Серед інших назв графіту відомі «чорний свинець», «карбідне залізо», «сріблястий свинець». У 1779 К. Шеєле встановив, що графіт можна окислити повітрям з утворенням вуглекислого газу.
Алмази вперше знайшли застосування в Індії, а в Бразилії дорогоцінні камені придбали комерційне значення в 1725; родовища в Південній Африці були відкриті в 1867. У XX столітті основними виробниками алмазів є ПАР, Заїр, Ботсвана, Намібія, Ангола, Сьєрра-Леоне, Танзанія і Росія. Штучні алмази, технологія яких була створена в 1970, виробляються для промислових цілей.
Фізичні та хімічні властивості. Відомі чотири кристалічні модифікації вуглецю: графіт, алмаз, карбін і лонсдейліт. графіт - сіро-чорна, непрозора, жирна на дотик, луската, дуже м'яка маса з металевим блиском, має електропровідністю. Атоми розташовані паралельними шарами, утворюючи гексагональну решітку. Усередині шару атоми пов'язані сильніше, ніж один шар з іншим, тому графіт може розшаровуватися. Згорає при 700єС в рісутствіі кисню. Зустрічається в природі; виходить штучно. При високій температурі, тиску і рісутствіі каталізатора (марганець Mn, хром Cr, платинові метали) графіт перетворюється на алмаз. алмаз - мінерал, що має жовтуватий, білий, сірий, зелений, рідше блакитний і чорний колір. Чи не проводить електричний струм, погано проводить тепло. У кристалі атоми вуглецю утворюють безперервний тривимірний каркас, що складається з зчленованих тетраедрів, що забезпечує високу міцність зв'язків. Алмаз - це найтвердіша речовина з усіх відомих. Температура плавлення вище 3500єС. Хімічно стійкий. Згорає при 870єС в присутності кисню. При 1800єС за відсутності кисню перетворюється в графіт. Прозорі кристали; після обробки - діаманти. Видобувають з розсипів і корінних родовищ. Синтетичний алмаз отримують з графіту при високих тиску і температурі. Він частіше напівпрозорий або непрозорий; має кристалічну структуру і властивості природного алмазу. рідкий карбон може бути отриманий при тиску вище 10,5 Мн / мІ (105 кгс / СМІ) і температурах вище 3700єС. Кокс, сажа, деревне вугілля ( твердий вуглець ) Мають ту ж будову, що і графіт.Для твердого вуглецю характерно також стан з неврегульованою структурою - так званий "Аморфний" вуглець , Яка не є самостійною модифікацією; в основі його будови лежить структура мелкокристаллического графіту. Нагрівання деяких різновидів "аморфного" вуглеводу вище за 1500-1600єС без доступу повітря викликає їх перетворення в графіт. Фізичні властивості "аморфного" вуглеводу дуже сильно залежать від дисперсності частинок і наявності домішок. Щільність, теплоємність, теплопровідність і електропровідність "аморфного" вуглецю завжди вище, ніж графіту. Карбин отриманий штучно. Він являє собою дрібнокристалічний порошок чорного кольору (щільність = 2 г / смі). Побудований з довгих ланцюжків атомів С, укладених паралельно один одному. лонсдейліт знайдений в метеоритах і отриманий штучно; його структура і властивості остаточно не встановлені.

А Б
Структура алмазу (а) і графіту (б).
Конфігурація зовнішньої електронної оболонки атома вуглецю 2sІ 2pІ . Для карбону характерне утворення чотирьох ковалентних зв'язків, обумовлене збудженням зовнішньої електронної оболонки до стану 2spі . Хімічна зв'язок може здійснюватися за рахунок sp3 -, sp2 - і sp- гібридних орбіталей, яким відповідають координаційні числа 4, 3 і 2. Число валентних електронів карбону і число валентних орбіталей однаково; це одна з причин стійкості зв'язку між атомами вуглецю.

Будова атома вуглецю.
Унікальна здатність атомів вуглецю з'єднуватися між собою з утворенням міцних і довгих ланцюгів і циклів призвела до виникнення величезного числа різноманітних з'єднань вуглецю (вуглеводнів), що вивчаються органічною хімією.
У з'єднаннях вуглець виявляє ступеня окислення -4; +2; +4. Атомний радіус 0,77Б, ковалентні радіуси 0,77Б, 0,67Б, 0,60Б відповідно в одинарному, подвійному і потрійному зв'язках; іонної радіус
С4 2,60Б, С4 + 0,20Б. При звичайних умовах карбон хімічно інертний, при високих температурах він сполучається з багатьма елементами, виявляючи сильні відновні властивості. Хімічна активність зменшується в ряді: "аморфний" вуглець, графіт, алмаз; взаємодія з киснем повітря (горіння) відбувається відповідно при температурах вище 300-500єС, 600-700єС і 850-1000єС з утворенням двоокису вуглецю CO2 і окису вуглецю CO.
CO2 розчиняється у воді з утворенням вугільної кислоти. У 1906 О. Дильс отримав недоокись вуглецю C3O2. Всі форми карбону стійкі до лугів і кислот і повільно окислюються тільки дуже сильними окислювачами (хромова суміш, суміш концентрованих HNO3 і KClO3 і ін.). "Аморфний" углеод реагує з фтором при кімнатній температурі, графіт і алмаз - при нагріванні. Безпосереднє з'єднання вуглецю з хлором відбувається в електричній дузі; з бромом і йодом вуглець не реагує, тому численні галогеніди вуглецю синтезують непрямим шляхом. З оксигалогенидів загальної формули COX2 (де Х - галоген) найбільш відома хлорокис COCl2 (фосген). водень з алмазом не взаємодіє; з графітом і "аморфним" вуглецем реагує при високих температурах у присутності каталізаторів (нікель Ni, платина Pt): при 600-1000єС утворюється в основному метан CH4, при 1500-2000єС - ацетилен C2H2, в продуктах можуть бути присутніми також інші вуглеводні, наприклад етан C2H6, бензол C6H6. взаємодія сірки з "аморфним" вуглецем і графітом починається при 700-800єС, з алмазом при 900-1000єС; у всіх випадках утворюється сірковуглець CS2. Інші сполуки вуглецю, що містять сірку (тіоокісь CS, тіонедоокись C3S2, оксисульфід COS і тіофосген CSCl2), отримують непрямим шляхом. При взаємодії CS2 з сульфідами металів утворюються тіокарбонати - солі слабкої тіовугільної кислоти. Взаємодія вуглецю з азотом з отриманням циана (CN) 2 відбувається при пропущенні електричного розряду між вугільними електродами в атмосфері азоту. Серед азотвмісних сполук вуглецю важливе практичне значення мають ціаністий водень HCN і його численні похідні: ціаніди, гало-генциани, нітрил і ін. При температурах вище 1000єС карбон взаємодіє з багатьма металами, Даючи карбіди. Всі форми вуглецю при нагріванні відновлюють оксиди металів з утворенням вільних металів (Zn, Cd, Cu, Pb і ін.) Або карбідів (CaC2, Mo2C, WC, TaC і ін.). Вуглець реагує при температурах вище 600-800 ° С з водяною парою і вуглекислим газом. Відмінною особливістю графіту є здатність при помірному нагріванні до 300-400єС взаємодіяти з лужними металами і галогенідами з утворенням з'єднань включення типу C8Me, C24Me, C8X (де Х - галоген, Me - метал). Відомі сполуки включення графіту з HNO3, H2SO4, FeCl3 і інші (наприклад, бісульфат графіту C24SO4H2). Всі форми вуглецю нерозчинні в звичайних неорганічних і органічних розчинниках, Але розчиняються в деяких розплавлених металах (наприклад, залізо Fe, нікель Ni, кобальт Co).
Ізотопи вуглецю. У природі відомо сім ізотопів вуглецю, з яких істотну роль грають три. Два з них - і - є стабільними, а один - - радіоактивним (в організмі людини його міститься близько 0,1 мккюрі). З використанням ізотопів вуглецю в біологічних і медичних дослідженнях пов'язані багато великих досягнень у вивченні обміну речовин і кругообігу вуглецю в природі. Так, за допомогою радіовуглецевого мітки була доведена можливість фіксації Н14СО3 рослинами і тканинами тварин, встановлена послідовність реакції фотосинтезу, вивчений обмін амінокислот, простежені шляхи біосинтезу багатьох біологічно активних сполук і т. Д. Застосування 14С сприяло успіхам молекулярної біології у вивченні механізмів біосинтезу білка і передачі спадкової інформації. Визначення питомої активності 14С в вуглецевмісних органічних залишках дозволяє судити про їх вік, що використовується в палеонтології і археології.
Вуглець в організмі. Вуглець - найважливіший біогенний елемент, що становить основу життя на Землі, структурна одиниця величезного числа органічних сполук, що беруть участь в побудові організмів і забезпеченні їх життєдіяльності (біополімери, а також численні низькомолекулярні біологічно активні речовини - вітаміни, гормони, медіатори та ін.). Значна частина необхідної організмам енергії утворюється в клітинах за рахунок окислення вуглецю. Виникнення життя на Землі розглядається в сучасній науці як складний процес еволюції вуглецевих сполук.
Роль вуглецю в живій природі. Унікальна роль карбону в живій природі зумовлена його властивостями, якими в сукупності не володіє жоден інший елемент періодичної системи. Між атомами вуглецю, а також між вуглецем і іншими елементами утворюються міцні хімічні зв'язки, які, однак, можуть бути розірвані в порівняно м'яких фізіологічних умовах (ці зв'язки можуть бути одинарними, подвійними і потрійними). Здатність вуглецю утворювати 4 рівнозначні валентні зв'язки з іншими атомами вуглецю створює можливість для побудови вуглецевих скелетів різних типів - лінійних, розгалужених, циклічних. Показово, що всього три елемента - вуглець С, кисень О і водень Н - становлять 98% загальної маси живих організмів. Цим досягається певна економічність в живій природі: при практично безмежній структурній різноманітності вуглецевих сполук невелике число типів хімічних зв'язків дозволяє набагато скоротити кількість ферментів, необхідних для розщеплення і синтезу органічних речовин. Особливості будови атома вуглецю лежать в основі різних видів ізомерії органічних сполук (здатність до оптичної ізомерії виявилася вирішальною в біохімічній еволюції амінокислот, вуглеводів і деяких алкалоїдів).
Згідно із загальноприйнятою гіпотезою А. І. Опаріна, перші органічні сполуки на Землі мали абиогенное походження. Джерелами вуглецю служили метан (CH4) і ціаністий водень (HCN), що містилися в первинній атмосфері Землі. З виникненням життя єдиним джерелом неорганічного вуглецю, за рахунок якого утворюється вся органічна речовина біосфери, є двоокис вуглецю (CO2), що знаходиться в атмосфері, а також розчинена в природних водах у вигляді HCO-3. Найбільш потужний механізм засвоєння (асиміляції) вуглецю (у формі CO2) - фотосинтез - здійснюється повсюдно зеленими рослинами (щорічно асимілюється близько 100 млрд. Т CO2). На Землі існує і еволюційне більш древній спосіб засвоєння CO2 шляхом хемосинтезу; в цьому випадку мікроорганізми-хемосинтетики використовують не променисту енергію Сонця, а енергію окислення неорганічних сполук. Більшість тварин споживають вуглець з їжею у вигляді вже готових органічних сполук. Залежно від способу засвоєння органічних сполук прийнято розрізнювати автотрофні організми і гетеротрофні організми. Застосування для біосинтезу білка та інших поживних речовин мікроорганізмів, що використовують як єдине джерело вуглецю вуглеводні нафти, - одна з важливих сучасних науково-технічних проблем.
Крім основної функції - джерела вуглецю - двоокис вуглецю CO2, розчинена в природних водах і в біологічних рідинах, бере участь у підтримці оптимальної для життєвих процесів кислотності середовища. У складі CaCO3 вуглець утворює зовнішній скелет багатьох безхребетних (наприклад, раковини молюсків), а також міститься в коралах, яєчній шкаралупі птахів і ін. Такі сполуки вуглецю, як HCN, CO, CCl4, що переважали в первинній атмосфері Землі в добіологічних період, надалі , в процесі біологічної еволюції, перетворилися на сильних антіметаболіти обміну речовин.
Кругообіг вуглецю. Вуглець - основний біогенний елемент; він грає найважливішу роль в утворенні живої речовини біосфери. Вуглекислий газ з атмосфери в процесі фотосинтезу, здійснюваного зеленими рослинами, асимілюється і перетворюється в різноманітні й численні органічні сполуки рослин. Рослинні організми, особливо нижчі мікроорганізми, морський фітопланктон, завдяки винятковій швидкості розмноження продукують в рік близько 1,5 · 10№№ т вуглецю у вигляді органічної маси, що відповідає
5,86 · 10Іє Дж (1,4 · 10Ієкал) енергії. Рослини частково поїдаються тваринами (при цьому утворюються більш-менш складні харчові ланцюги). В остаточному підсумку органічна речовина в результаті дихання організмів, розкладання їх трупів, процесів бродіння, гниття і горіння перетворюється на вуглекислий газ або відкладається у вигляді сапропелю, гумусу, торфу, які, в свою чергу, дають початок багатьом ін. Каустобиолитам - кам'яним вугіллям, нафти, пальним газам.

Кругообіг вуглецю.
У процесах розпаду органічних речовин, їх мінералізації величезну роль грають бактерії (наприклад, гнильні), а також багато гриби (наприклад, плісняви).
В активному круговороті вуглецю бере участь дуже невелика частина всієї його маси. Величезна кількість вугільної кислоти законсервовано у вигляді викопних вапняків та інших порід. Між вуглекислим газом атмосфери і водою океану, в свою чергу, існує рухлива рівновага.
Таблиця: Зміст вуглецю на поверхні Землі й у земній корі (16 км потужності)
В тВ г на 1 смІ поверхні Землі
Тварини 5 · 109 0,0015
Рослини 5 · 10№№ 0,1
Атмосфера 6,4 · 10№№ 0,125
Океан 3,8 · 10№і 7,5
масивні кристалічні
породи: базальти і ін. 1,7 · 1014 33,0
основні породи
Граніти, гранодіорити 2,9 · 1015 567
Вугілля, нафти та інші
каустобіоліти 6,4 · 1015 663
Кристалічні сланці 1 · 1016 2000
Карбонати 1,3 · 1016 2500
Всього 3,2 · 1016 5770
Багато водні організми поглинають вуглекислий кальцій, створюють свої скелети, а потім з них утворюються пласти вапняків. З атмосфери було вилучено й поховано в десятки тисяч разів більше вуглекислого газу, ніж в ній знаходиться в даний момент. Атмосфера поповнюється вуглекислим газом завдяки процесам розкладання органічної речовини, карбонатів і ін., А також, все в більшій мірі, в результаті індустріальної діяльності людини. Особливо потужним джерелом є вулкани, гази яких складаються головним чином з вуглекислого газу і водяної пари. Деяка частина вуглекислого газу і води, що викидаються вулканами, відроджується з осадових порід, зокрема вапняків, при контакті магми з ними і їх асиміляції магмою. У процесі кругообігу вуглецю відбувається кількаразове фракціонування його за ізотопним складом (№ІC - №іC), особливо в магматогенном процесі (освіту CO2, алмазів, карбонатів), при біогенному освіту органічної речовини (вугілля, нафти, тканин організмів і ін.).
Застосування вуглецю. Карбон широко використовується у вигляді простих речовин. дорогоцінний алмаз є предметом ювелірних прикрас; непрозорий алмаз - цінний абразив, а так же матеріал для виготовлення різців і іншого інструменту. Деревне вугілля і інші аморфні форми вуглецю застосовуються для знебарвлення, очищення, адсорбції газів, в областях техніки, де потрібні адсорбенти з розвиненою поверхнею. графіт застосовують для виготовлення плавильних тиглів, футеровочних плит, електродів, твердих мастильних матеріалів; в ракетній техніці; як сповільнювач нейтронів в ядерних реакторах; компонент складу для виготовлення стрижнів для арандашей; для отримання алмазу; наповнювач пластмас. кам'яновугільний кокс використовується в чорній металургії як паливо і відновника в доменних печах і вагранках. Нафтовий і електродний пековий кокс застосовується для виготовлення вугільних і графітованих електродів, рідше - як паливо. сажа (Технічний вуглець) застосовується як наповнювач у виробництві гуми, пластмас; пігмент в лакофарбової промисловості; для виготовлення електродів і т. п. карбіди, Сполуки вуглецю з металами, а також з бором і кремнієм (наприклад, Al4C3, SiC, B4C) відрізняються високою твердістю і використовуються для виготовлення абразивного і ріжучого інструменту. вуглець застосовується для отримання металів з їх оксидів. Вуглець входить до складу сталей і сплавів в елементному стані і у вигляді карбідів. Насичення поверхні сталевих виливків вуглецем при високій температурі (цементація) значно збільшує поверхневу твердість і зносостійкість.

Застосування алмазу в ювелірних прикрасах,
графіту в олівцях.
Список літератури:1) "Велика шкільна енциклопедія", т. 2, вид. "Олма-пресс"
2) Інтернет: www.encycl.yandex, www.krugosvet, wwwrmika.
Два десятиліття поспіль вугілля знаходився в тіні нафтового буму. Гори не знаходила збут вугілля росли в небо. Закривалися численні шахти, сотні тисяч гірників втрачали своє робоче місце. Район Аппалачів США, колись квітучий вугільний басейн, перетворився в один з найбільш похмурих районів бедс ...
Будова атома водню в періодичній системі. Ступені окислення. Поширеність в природі. Водень, як проста речовина, молекули якого складаються з двох атомів, пов'язаних між собою ковалентним неполярной зв'язком. Фізико-хімічні властивості.
Алмаз. При слові "алмаз" відразу ж згадуються оповиті завести таємниці історії, що розповідають про пошуки сокровіщ.Когда-то люди, що полювали за алмазами, і не підозрювали, що предметів їх пристрасті є кристалічний вуглець-той самий вуглець, який утворює сажу, кіптяву і вугілля .Впе ...
Відомості про вуглець, висхідні до давнину і поширення його в природі. Наявність вуглецю в земній корі. Фізичні та хімічні властивості вуглецю. Отримання і застосування вуглецю і його сполук. Адсорбційна здатність активованого вугілля.
Хімічні властивості простих речовин. Загальні відомості про вуглець і кремній. Хімічні сполуки вуглецю, його кисневі і азотовмісні похідні. Карбіди, розчинні і нерозчинні у воді і розведених кислотах. Кисневі сполуки кремнію.
Вуглець (С) - типовий неметалл; в періодичній системі знаходиться в 2-му періоді IV групі, головній підгрупі. Порядковий номер 6, Ar = 12,011 а.е.м., заряд ядра +6.Фізичні властивості: вуглець утворює безліч аллотропних модифікацій: алмаз - одне із самих твердих речовин, графіт, вугілля, сажа.
Атом вуглецю має 6 електронів: 1s 2 2s 2 2p 2 . Останні два електрона розташовуються на окремих р-орбіталях і є неспареними. В принципі, ця пара могла б займати одну орбіталь, але в такому випадку сильно зростає межелектронного відштовхування. З цієї причини один з них займає 2р х, а інший, або 2р у , або 2р z орбіталі.
Різниця енергії s- і р-підрівнів зовнішнього шару невелика, тому атом досить легко переходить в збуджений стан, при якому один з двох електронів з 2s-орбіталі переходить на вільну 2р. Виникає валентний стан, що має конфігурацію 1s 2 2s 1 2p x 1 2p y 1 2p z 1 . Саме такий стан атома вуглецю характерно для решітки алмаза - тетраедричну просторове розташування гібридних орбіталей, однакова довжина і енергія зв'язків.
Це явище, як відомо, називають sp 3-гібридизація, а виникаючі функції - sp 3 -гібріднимі . Освіта чотирьох sp 3 -cвязeй забезпечує атому вуглецю більш стійкий стан, ніж три р-р- і одна s-s-зв'язку. Крім sp 3-гібридизації у атома вуглецю спостерігається також sp 2 - і sp-гібридизація . У першому випадку виникає взаємне накладення s- і двох р-орбіталей. Утворюються три рівнозначні sp 2 - гібридних орбіталі, розташовані в одній площині під кутом 120 ° один до одного. Третя орбиталь р незмінна і спрямована перпендикулярно площині sp 2.

При sp-гібридизації відбувається накладення орбіталей s і р. Між двома утворюються рівноцінними гібридними орбиталями виникає кут 180 °, при цьому дві р-орбіталі у кожного з атомів залишаються незмінними.
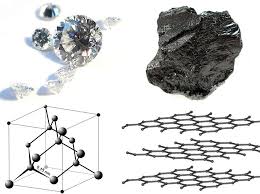
Аллотрорпія вуглецю. Алмаз і графіт
У кристалі графіту атоми вуглецю розташовані в паралельних площинах, займаючи в них вершини правильних шестикутників. Кожен з атомів вуглецю пов'язаний з трьома сусідніми sp 2 -гібріднимі зв'язками. Між паралельними площинами зв'язок здійснюється за рахунок ван дер Ваальсових сил. Вільні р-орбіталі кожного з атомів спрямовані перпендикулярно площинам ковалентних зв'язків. Їх перекриванням пояснюється додаткова π-зв'язок між атомами вуглецю. Таким чином, від валентного стану, в якому перебувають атоми вуглецю в речовині, залежать властивості цієї речовини.
Найбільш характерні ступені окислення: +4, +2.
При низьких температурах вуглець інертний, але при нагріванні його активність зростає.
- з киснем
C 0 + O 2 - t ° = CO 2 вуглекислий газ
при нестачі кисню - неповне згоряння:
2C 0 + O 2 - t ° = 2C +2 O чадний газ
- зі фтором
З + 2F 2 = CF 4
- з водяною парою
C 0 + H 2 O - 1200 ° = С +2 O + H 2 водяний газ
- з оксидами металів. Таким чином виплавляють метал з руди.
C 0 + 2CuO - t ° = 2Cu + C +4 O 2
- з кислотами - окислювачами:
C 0 + 2H 2 SO 4 (конц.) = С +4 O 2 + 2SO 2 + 2H 2 O
З 0 + 4HNO 3 (конц.) = С +4 O 2 + 4NO 2 + 2H 2 O
- з сірої утворює сероуглерод:
З + 2S 2 = СS 2.
- з деякими металами утворює карбіди
4Al + 3C 0 = Al 4 C 3
Ca + 2C 0 = CaC 2 -4
- з воднем - метан (а також величезна кількість органічних сполук)
C 0 + 2H 2 = CH 4
- з кремнієм, утворює карборунд (при 2000 ° C в електропечі):
Ссвободний вуглець зустрічається у вигляді алмазу і графіту. У вигляді сполук вуглець знаходиться в складі мінералів: крейди, мармуру, вапняку - СаСО 3, доломіту - MgCO 3 * CaCO 3; гідрокарбонатів - Mg (НCO 3) 2 і Са (НCO 3) 2, СО 2 входить до складу повітря; вуглець є головною складовою частиною природних органічних сполук - газу, нафти, кам'яного вугілля, торфу, входить до складу органічних речовин, білків, жирів, вуглеводів, амінокислот, що входять до складу живих організмів.

Ні іони С 4+, ні З 4 - ні за яких звичайних хімічних процесах не утворюються: у з'єднаннях вуглецю є ковалентні зв'язки різної полярності.
Чадний газ; безбарвний, без запаху, малорастворим в воді, розчинний в органічних розчинниках, отруйний, t ° кип = -192 ° C; t пл. = -205 ° C.
отримання
1) У промисловості (в газогенераторах):
C + O 2 = CO 2
2) В лабораторії - термічним розкладанням мурашиної або щавлевої кислоти в присутності H 2 SO 4 (конц.):
HCOOH = H 2 O + CO
H 2 C 2 O 4 = CO + CO 2 + H 2 O
Хімічні властивості
При звичайних умовах CO інертний; при нагріванні - відновник; несолеобразующіе оксид.
1) з киснем
2C +2 O + O 2 = 2C +4 O 2
2) з оксидами металів
C +2 O + CuO = Сu + C +4 O 2
3) з хлором (на світлі)
CO + Cl 2 - hn = COCl 2 (фосген)
4) реагує з розплавами лугів (під тиском)
CO + NaOH = HCOONa (форміат натрію)
5) з перехідними металами утворює карбоніли
Ni + 4CO - t ° = Ni (CO) 4
Fe + 5CO - t ° = Fe (CO) 5
Вуглекислий газ, безбарвний, без запаху, розчинність в воді - в 1V H 2 O розчиняється 0,9V CO 2 (при нормальних умовах); важчий за повітря; t ° пл. = -78,5 ° C (твердий CO 2 називається "сухий лід"); не підтримує горіння.
отримання
CaCO 3 - t ° = CaO + CO 2
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2
NaHCO 3 + HCl = NaCl + H 2 O + CO 2
хімічнівластивостіСO2
Кислотний оксид: реагує з основними оксидами і підставами, утворюючи солі вугільної кислоти
Na 2 O + CO 2 = Na 2 CO 3
2NaOH + CO 2 = Na 2 CO 3 + H 2 O
NaOH + CO 2 = NaHCO 3
При підвищеній температурі може проявляти окислювальні властивості
З +4 O 2 + 2Mg - t ° = 2Mg +2 O + C 0
якісна реакція
Помутніння вапняної води:
Ca (OH) 2 + CO 2 = CaCO 3 ¯ (білий осад) + H 2 O
Воно зникає при тривалому пропущенні CO 2 через вапняну воду, тому що нерозчинний карбонат кальцію переходить в розчинний гідрокарбонат:
CaCO 3 + H 2 O + CO 2 = Са (HCO 3) 2
H 2CO 3 -Кислота слабка, існує тільки у водному розчині:
CO 2 + H 2 O ↔ H 2 CO 3
двоосновна:
H 2 CO 3 ↔ H + + HCO 3 - Кислі солі - бікарбонати, гідрокарбонати
HCO 3 - ↔ H + + CO 3 2- Cредние солі - карбонати
Характерні все властивості кислот.
Карбонати і гідрокарбонати можуть перетворюватися один в одного:
2NaHCO 3 - t ° = Na 2 CO 3 + H 2 O + CO 2
Na 2 CO 3 + H 2 O + CO 2 = 2NaHCO 3
Карбонати металів (крім лужних металів) при нагріванні декарбоксилируется з утворенням оксиду:
CuCO 3 - t ° = CuO + CO 2
якісна реакція - "закипання" при дії сильної кислоти:
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
CO 3 2- + 2H + = H 2 O + CO 2
Карбід кальцію:
CaO + 3 C = CaC 2 + CO
CaC 2 + 2 H 2 O = Ca (OH) 2 + C 2 H 2.
Ацетилен виділяється при реакції з водою карбідів цинку, кадмію, лантану і церію:
2 LaC 2 + 6 H 2 O = 2La (OH) 3 + 2 C 2 H 2 + H 2.
Be 2 C і Al 4 C 3 розкладаються водою з утворенням метану:
Al 4 C 3 + 12 H 2 O = 4 Al (OH) 3 = 3 CH 4.
У техніці застосовують карбіди титану TiC, вольфраму W 2 C (тверді сплави), кремнію SiC (карборунд - як абразив і матеріалу для нагрівачів).
отримують при нагріванні соди в атмосфері аміаку і чадного газу:
Na 2 CO 3 + 2 NH 3 + 3 CO = 2 NaCN + 2 H 2 O + H 2 + 2 CO 2
Синильна кислота HCN - важливий продукт хімічної промисловості, широко застосовується в органічному синтезі. Її світове виробництво досягає 200 тис. Т на рік. Електронна будова ціанід-аніону аналогічно оксиду вуглецю (II), такі частинки називають ізоелектронними:
C = O: [: C = N:] -
Ціаніди (0,1-0,2% -ний водний розчин) застосовують при видобутку золота:
2 Au + 4 KCN + H 2 O + 0,5 O 2 = 2 K + 2 KOH.
При кип'ятінні розчинів ціанідів з сіркою або сплаві твердих речовин утворюються роданіди:
KCN + S = KSCN.
При нагріванні ціанідів малоактивних металів виходить диціан: Hg (CN) 2 = Hg + (CN) 2. Розчини ціанідів окислюються до ціанатів:
2 KCN + O 2 = 2 KOCN.
Ціанової кислота існує в двох формах:
H-N = C = O; H-O-C = N:
У 1828 році Фрідріх Велер (1800-1882) отримав з цианата амонію сечовину: NH 4 OCN = CO (NH 2) 2 при упарюванні водного розчину.
Ця подія зазвичай розглядається як перемога синтетичної хімії над "вітаїстичною теорією".
Існує ізомер ціанової кислоти - гримуча кислота
H-O-N = C.
Її солі (гримуча ртуть Hg (ONC) 2) використовуються в ударних воспламенителях.
синтез сечовини (Карбаміду):
CO 2 + 2 NH 3 = CO (NH 2) 2 + H 2 O. При 130 0 С і 100 атм.
Сечовина є амідом вугільної кислоти, існує і її "азотний аналог" - гуанидин.
Найважливіші неорганічні сполуки вуглецю - солі вугільної кислоти (карбонати). H 2 CO 3 - слабка кислота (К 1 = 1,3 · 10 -4; К2 = 5 · 10 -11). Карбонатний буфер підтримує вуглекислотне рівновагу в атмосфері. Світовий океан володіє величезною буферною ємністю, тому що він є відкритою системою. Основна буферна реакція - рівновагу при дисоціації вугільної кислоти:
H 2 CO 3 ↔ H + + HCO 3 -.
При зниженні кислотності відбувається додаткове поглинання вуглекислого газу з атмосфери з утворенням кислоти:
CO 2 + H 2 O ↔ H 2 CO 3.
При підвищенні кислотності відбувається розчинення карбонатних порід (раковини, крейдяні і вапнякові відкладення в океані); цим компенсується спад гідрокарбонатних іонів:
H + + CO 3 2- ↔ HCO 3 -
CaCO 3 (тв.) ↔ Ca 2+ + CO 3 2-
Тверді карбонати переходять в розчинні гідрокарбонати. Саме цей процес хімічного розчинення надлишкового вуглекислого газу протидіє "парникового ефекту" - глобальному потеплінню через поглинання вуглекислим газом теплового випромінювання Землі. Приблизно третина світового виробництва соди (карбонат натрію Na 2 CO 3) використовується у виробництві скла.
ВИЗНАЧЕННЯ
вуглець - шостий елемент Періодичної таблиці. Позначення - С від латинського «carboneum». Розташований у другому періоді, IVА групі. Відноситься до неметалів. Заряд ядра дорівнює 6.
Вуглець знаходиться в природі як у вільному стані, так і у вигляді численних сполук. Вільний вуглець зустрічається у вигляді алмазу і графіту. Крім викопного вугілля, в надрах Землі знаходяться великі скупчення нафти. У земній корі зустрічаються у величезних кількостях солі вугільної кислоти, особливо карбонат кальцію. У повітрі завжди є діоксид вуглецю. Нарешті, рослинні і тваринні організми складаються з речовин, в утворенні яких участь приймає вуглець. Таким чином, цей елемент - один з найпоширеніших на Землі, хоча загальне його вміст в земній корі становить усього близько 0,1% (мас.).
Відносної молекулярна маса речовини (M r) - це число, яке показує, у скільки разів маса даної молекули більше 1/12 маси атома вуглецю, а відносна атомна маса елемента (A r) - у скільки разів середня маса атомів хімічного елемента більше 1/12 маси атома вуглецю.
Оскільки у вільному стані вуглець існує у вигляді одноатомних молекул С, значення його атомної і молекулярної мас збігаються. Вони рівні 12,0064.
У вільному стані вуглець існує у вигляді алмазу, що кристалізується в кубічної і гексагональної (лонсдейліт) системі, і графіту, що належить до гексагональної системі (рис. 1). Такі форми вуглецю, як деревне вугілля, кокс або сажа мають невпорядковану структуру. Також є аллотропние модифікації, отримані синтетичним шляхом - це карбін і полікумулен - різновиди вуглецю, побудовані з лінійних ланцюгових полімерів типу -C = C- або = C = C =.
Мал. 1. Алотропні модифікації вуглецю.
Відомі також аллотропние модифікації вуглецю, що мають такі назви: графен, фулерен, нанотрубки, нановолокна, Австралія, стеклоуглерож, колосальні нанотрубки; аморфний вуглець, вуглецеві нанопочкі і вуглецева нанопіна.
У природі вуглець існує у вигляді двох стабільних ізотопів 12 С (98,98%) і 13 С (1,07%). Їх масові числа рівні 12 і 13 відповідно. Ядро атома ізотопу вуглецю 12С містить шість протонів і шість нейтронів, а ізотопу 13 С - така ж кількість протонів і п'ять нейтронів.
Існує один штучний (радіоактивний) ізотоп вуглецю 14 Сс періодом напіврозпаду рівним 5730 років.
На зовнішньому енергетичному рівні атома вуглецю є чотири електрона, які є валентними:
1s 2 2s 2 2p 2.
В результаті хімічної взаємодії вуглець може втрачати свої валентні електрони, тобто бути їх донором, і перетворюватися в позитивно заряджені іони або приймати електрони іншого атома, тобто бути їх акцептором, і перетворюватися в негативно заряджені іони:
З 0 -2e → З 2+;
З 0 -4e → З 4+;
З 0 + 4e → З 4.
У вільному стані вуглець існує у вигляді одноатомних молекул С. Наведемо деякі властивості, що характеризують атом і молекулу вуглецю:
Найбільш відомі сплави вуглецю в усьому світі - це сталь і чавун. Сталь - це сплав заліза з вуглецем, вміст вуглецю в якому не перевищує 2%. У чавуні (теж сплав заліза з вуглецем) вміст вуглецю вище - від 2-х до 4%.
ПРИКЛАД 1
| завдання | Який обсяг оксиду вуглецю (IV) виділиться (н.у.) при випалюванні 500 г вапняку, що містить 0,1 масову частку домішок. |
| Рішення | Запишемо рівняння реакції випалу вапняку: CaCO 3 = CaO + CO 2 -. Знайдемо масу чистого вапняку. Для цього спочатку визначимо його масову частку без домішок: w clear (CaCO 3) = 1 - w impurity = 1 - 0,1 = 0,9. m clear (CaCO 3) = m (CaCO 3) × w clear (CaCO 3); m clear (CaCO 3) = 500 × 0,9 = 450 м Розрахуємо кількість речовини вапняку: n (CaCO 3) = m clear (CaCO 3) / M (CaCO 3); n (CaCO 3) = 450/100 = 4,5 моль. Відповідно до рівняння реакції n (CaCO 3): n (CO 2) = 1: 1, значить n (CaCO 3) = n (CO 2) = 4,5 моль. Тоді, обсяг виділився оксиду вуглецю (IV) буде дорівнює: V (CO 2) = n (CO 2) × V m; V (CO 2) = 4,5 × 22,4 = 100,8 л. |
| відповідь | 100,8 л |
ПРИКЛАД 2
| завдання | Скільки буде потрібно розчину, що містить 0,05 масових часткою, або 5% хлороводню, для нейтралізації 11,2 г карбонату кальцію? |
| Рішення | Запишемо рівняння реакції нейтралізації карбонату кальцію хлороводородом: CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 -. Знайдемо кількість речовини карбонату кальцію: M (CaCO 3) = A r (Ca) + A r (C) + 3 × A r (O); M (CaCO 3) = 40 + 12 + 3 × 16 = 52 + 48 = 100 г / моль. n (CaCO 3) = m (CaCO 3) / M (CaCO 3); n (CaCO 3) = 11,2 / 100 = 0,112 моль. Відповідно до рівняння реакції n (CaCO 3): n (HCl) = 1: 2, значить n (HCl) = 2 × n (CaCO 3) = 2 × 0,224 моль. Визначимо масу речовини хлороводню, що міститься в розчині: M (HCl) = A r (H) + A r (Cl) = 1 + 35,5 = 36,5 г / моль. m (HCl) = n (HCl) × M (HCl) = 0,224 × 36,5 = 8,176 м Розрахуємо масу розчину хлороводню: m solution (HCl) = m (HCl) × 100 / w (HCl); m solution (HCl) = 8,176 × 100/5 = 163,52 м |
| відповідь | 163,52 г |