Výpočet výkonu pro proud a napětí
Jak víte, elektrické napětí by mělo mít vlastní měřítko, které zpočátku odpovídá hodnotě, která ...
Uhlík.
Uhlík (Carboneum), C - chemický prvek ze skupiny IV, sekundární podskupina, 2. období periodického systému DI Mendeleev, sériové číslo 6. Relativní atomová hmotnost: 12,011. Elektronegativita: 2.6. Bod tání: 3370 ° C (popáleniny). Bod varu: 4200˚С. Hustota (grafit): 2,27 g / cm. Počet uhlíkových minerálů je 112; počet organických sloučenin uhlíku - uhlovodíků a jejich derivátů - je extrémně velký. Uhlík se nachází v přírodě ve volném stavu (ve formě diamantu, grafitu) a ve formě sloučenin (obsažených v hořlavých břidlicích, lignitovém a asfaltovém uhlí, rašelině a ve formě sloučenin v ropě, přírodních hořlavých plynech, v uhličitanech). Všechny živé organismy jsou z uhlíkových sloučenin. Uhlí je rozšířený, ale jeho obsah v zemské kůře je jen 0,19%; také uhlík je ve vesmíru rozšířen; na slunci, zaujímá 4. místo po vodíku, heliu a kyslíku. Ve srovnání s průměrným obsahem zemské kůry lidstvo získává uhlík z hlubin (uhlí, ropa, zemní plyn) ve velmi velkém množství, protože tyto minerály jsou hlavním zdrojem energie.
Historické pozadí. V roce 1778 K. Scheele zahříval grafit s dusičnanem, když zjistil, že zatímco se zahřívá dusičnan uhličitý, uvolňuje se oxid uhličitý. Chemické složení diamantu bylo zjištěno v důsledku experimentů A. Lavoisiera (1772) o studiích spalování diamantů ve vzduchu ao studiích S. Tennanta (1797), kteří dokázali, že stejné množství oxidu uhličitého během oxidace je stejné množství diamantu a uhlí. Uhlík byl uznán za chemický prvek v roce 1789 od Lavoisiera. Latinský název uhlík uhlík odvozený z "carbo" - uhlí. A v roce 1961 vzala Mezinárodní svaz teoretické a aplikované chemie (IUPAC) a ve fyzice hmotnost 12C uhlíkového izotopu jako jednotku atomové hmoty, čímž eliminovala kyslíkovou stupnici atomových hmot, která existovala předtím. Atomová hmotnost uhlíku v tomto systému je 12 011, jelikož je průměrná pro tři přirozené uhlíkové izotopy, přičemž se přihlíží k jejich hojnosti v přírodě.
Uhlí byl znám již od starověku. Dlouho je známo, že jiný materiál může být označen grafitem a samotný název "grafit" odvozený z řeckého slova "psát" navrhl A. Verner v roce 1789. Historie grafitu je však zmatená, často s látkami s podobnými vnějšími fyzikálními vlastnostmi. , například molybdenit (sulfid molybdenu), byl najednou považován za grafit. Mezi jiné názvy grafitu jsou známé "černé olovo", "karbidové železo", "stříbrné olovo". V roce 1779 K. Scheele prokázal, že grafit může být oxidován vzduchem za vzniku oxidu uhličitého.
Diamanty byly poprvé použity v Indii av Brazílii získaly drahé kameny v roce 1725 komerční význam; Vklady v Jižní Africe byly objeveny v roce 1867. V 20. století jsou hlavními producenty diamantů Jihoafrická republika, Zaire, Botswana, Namibie, Angola, Sierra Leone, Tanzanie a Rusko. Umělé diamanty, jejichž technologie byla vytvořena v roce 1970, jsou vyráběny pro průmyslové účely.
Fyzikální a chemické vlastnosti. Jsou známy čtyři modifikace krystalického uhlíku: grafit, diamant, carbin a lonsdaleite. Grafit - šedo-černá, neprůhledná, mastná na dotek, šupinatá, velmi měkká hmota s kovovým leskem, má elektrickou vodivost. Atomy jsou uspořádány v rovnoběžných vrstvách a vytvářejí šestiúhelníkovou mřížku. Uvnitř vrstvy jsou atomy silněji spojeny než jedna vrstva s druhou, proto grafit může být rozvrstvený. Hoří při teplotě 700 ° C za přítomnosti kyslíku. Vyskytuje se v přírodě; Ukázalo se to uměle. Při vysokých teplotách, tlaku a přítomnosti katalyzátoru (mangan Mn, chromový Cr, platinové kovy) se grafit mění na diamant. Diamond - minerál s nažloutlou, bílou, šedou, nazelenalou, méně často modrou a černou barvou. Nevede elektrický proud, špatně vede teplo. V krystalu tvoří atomy uhlíku souvislý trojrozměrný rám sestávající z kloubových čtyřstěn, které zajišťují vysokou pevnost vazby. Diamant je tou nejtěžší látkou, která byla známa. Bod tání nad 3500 ° С. Chemicky odolný. Hoří při teplotě 870 ° C za přítomnosti kyslíku. Při 1800 ° C za nepřítomnosti kyslíku se změní na grafit. Čiré krystaly; po zpracování - diamanty. To je extrahováno z plastikářů a primárních usazenin. Syntetický diamant se získává z grafitu při vysokém tlaku a teplotě. Je často průsvitný nebo neprůhledný; Má krystalickou strukturu a vlastnosti přírodního diamantu. Kapalný uhlík lze dosáhnout při tlaku vyšším než 10,5 Mn / m2 (105 kgf / cm2) a teplotách vyšších než 3700 ° C Koks, saze, uhlí ( pevný uhlík ) mají stejnou strukturu jako grafit. U tuhého uhlí je také charakteristický stav s neuspořádanou strukturou - tzv "amorfní" uhlík což není vlastní modifikace; Jádrem struktury je struktura krystalického grafitu. Ohřev některých odrůd "amorfního" uhlíku nad 1500-1600 ° C bez přístupu vzduchu způsobuje jejich přeměnu na grafit. Fyzikální vlastnosti "amorfního" uhlíku jsou velmi závislé na rozptylu částic a přítomnosti nečistot. Hustota, tepelná kapacita, tepelná vodivost a elektrická vodivost "amorfního" uhlíku jsou vždy vyšší než grafit. Carbin získané uměle. Je to jemnozrnný černý prášek (hustota = 2 g / cm). Vyrobeno z dlouhých řetězců atomů C, které jsou vzájemně paralelní. Lonsdaleite nalezené v meteoritech a uměle získané; jeho struktura a vlastnosti nejsou plně zavedeny.

A B
Struktura diamantu (a) a grafitu (b).
Konfigurace vnějšího elektronového obalu atomu uhlíku 2sІ 2pІ . Uhlík je charakterizován tvorbou čtyř kovalentních vazeb v důsledku excitace vnějšího elektronového pláště do stavu 2spі . Chemická vazba může být provedena pomocí sp3 -, sp2 - a sp- hybridní orbitály, které odpovídají koordinačním číslům 4, 3 a 2. Počet valenčních elektronů uhlíku a počet valenčních orbitálů jsou stejné; To je jeden z důvodů stability vazby mezi atomy uhlíku.

Struktura atomu uhlíku.
Jedinečná schopnost atomů uhlíku spojit se s tvorbou silných a dlouhých řetězců a cyklů vedla k vzniku obrovského množství různých sloučenin uhlíku (uhlovodíků), které byly studovány organickou chemii.
Ve sloučeninách uhlík vykazuje oxidační stavy -4; +2; +4. Atomový poloměr 0,77B, kovalentní poloměry 0,77B, 0,67B, 0,60B v jedné, dvojnásobné a trojité vazbě; iontový poloměr
C4 - 2, 60B, C4 + 0,20B. Za normálních podmínek je uhlík chemicky inertní, při vysokých teplotách se kombinuje s mnoha prvky, které vykazují silné redukční vlastnosti. Chemická aktivita se snižuje v sérii: "amorfní" uhlík, grafit, diamant; interakce s kyslíkem ve vzduchu (spalování) nastává při teplotách nad 300-500 ° C, 600-700 ° C a 850-1000 ° C při tvorbě oxidu uhličitého CO2 a oxidu uhelnatého CO.
CO2 se rozpouští ve vodě za vzniku kyseliny uhličité. V roce 1906 obdržel O. Diels oxid uhličitý C3O2. Všechny formy uhlíku jsou odolné vůči zásadám a kyselinám a jsou pomalu oxidovány pouze velmi silnými oxidačními činidly (směs chromu, směs koncentrované HNO3 a KClO3 atd.). "Amorfní" uhlík reaguje fluoru při pokojové teplotě, grafitu a diamantu - při zahřátí. Přímá sloučenina uhlíku s chlor dochází v elektrickém oblouku; s bromu a jod Uhlík nereaguje, proto jsou nepřímo syntetizovány četné uhlíkové halogenidy. Z oxyhalogenidů obecného vzorce COX2 (kde X je halogen) je nejznámější chloroxid COCI2 (fosgen). Vodík nereaguje s diamanty; s grafitem a "amorfním" uhlíkem reaguje při vysokých teplotách za přítomnosti katalyzátorů (nikl nikl, platina Pt): při 600-1000 ° C se tvoří hlavně metan CH4, při 1500-2000 ° C - acetylen C2H2, mohou být ve výrobcích přítomny i jiné uhlovodíky C2H6, benzen C6H6. Interakce síry s "amorfním" uhlíkem a grafitem začíná při 700-800 ° C, s diamanty při 900-1000 ° C; ve všech případech se vytváří sulfid uhličitý CS2. Další sloučeniny uhlíku obsahující síru (CS thioxid, thionoxid C3S2, COS oxid síry a CSCI2 thiofosgen) se získají nepřímo. Když CS2 interaguje se sulfidy kovů, vytvářejí se thiokarbonáty - soli slabé thiogolové kyseliny. Uhlíková interakce s dusíku (CN) 2, dochází tím, že prochází elektrický výboj mezi uhlíkovými elektrodami v dusíkové atmosféře. Mezi dusíkatými sloučeninami uhlíku je důležitý kyanovodík HCN a jeho četné deriváty: kyanidy, halogenidy, nitrily atd. Při teplotách nad 1000 ° C uhlík reaguje s mnoha kovydávají karbidy. Veškeré formy uhlíku redukují oxidy kovů při zahřátí za vzniku volných kovů (Zn, Cd, Cu, Pb atd.) Nebo karbidů (CaC2, Mo2C, WC, TaC atd.). Uhlík reaguje při teplotách nad 600-800 ° C vodní páry a oxid uhličitý. Charakteristickým rysem grafitu je schopnost interakce s alkalickými kovy a halogenidy se středním ohřevem až na 300 až 400 ° C za vzniku inklúzních sloučenin jako C8Me, C24Me, C8X (kde X je halogen, Me je kov). Známé sloučeniny obsahují grafit s HNO3, H2S04, FeCl3 a další (například grafitový bisulfát C24S04H2). Všechny formy uhlíku jsou nerozpustné v běžných anorganických a organických rozpouštědla, ale rozpouští se v některých roztavených kovu (například železo Fe, nikl nikl, kobalt Co).
Uhlíkové izotopy. V přírodě jsou známé sedm uhlíkových izotopů, z nichž tři hrají významnou roli. Dvě z nich jsou - a - jsou stabilní a jedna je - radioaktivní (obsahuje asi 0,1 v lidském těle mkkyuri). Mnoho významných pokroků ve studiu metabolismu a uhlíkového cyklu v přírodě souvisí s používáním uhlíkových izotopů v biologickém a lékařském výzkumu. Při použití radiokarbonového značení byla prokázána možnost fixace H14C03 rostlinami a živočišnými tkáněmi, byla provedena sekvence fotosyntézní reakce, byl studován metabolismus aminokyselin, byly sledovány cesty biosyntézy mnoha biologicky aktivních sloučenin atd. Použití 14C přispělo k úspěchu biosyntézy a přenosu proteinů dědičné informace. Stanovení specifické aktivity 14C v organických zbytcích obsahujících uhlík umožňuje posoudit jejich věk, který se používá v paleontologii a archeologii.
Uhlík v těle. Uhlík je nejdůležitějším biogenním prvkem, který tvoří základ života na Zemi, strukturní jednotku obrovského množství organických sloučenin, které se podílejí na konstrukci organismů a jejich živobytí (biopolymery, stejně jako množství nízkomolekulárních biologicky aktivních látek - vitamíny, hormony, mediátory atd.). Významná část energie požadované organismy je produkována v buňkách díky oxidaci uhlíku. Vznik života na Zemi je v moderní vědě považován za složitý proces vývoje sloučenin uhlíku.
Úloha uhlíku ve volné přírodě. Unikátní úloha uhlíku v živé přírodě je způsobena jeho vlastnostmi, které společně nemají žádný jiný prvek periodického systému. Mezi atomy uhlíku, jakož i mezi uhlíkem a jinými prvky se vytvářejí silné chemické vazby, které však mohou být přerušeny v poměrně mírných fyziologických podmínkách (tyto vazby mohou být jednoduché, dvojité nebo trojité). Schopnost uhlíku vytvářet 4 ekvivalentní valenční vazby s jinými atomy uhlíku umožňuje vytvářet uhlíkové kostry různých typů - lineární, rozvětvené, cyklické. Je důležité, že jen tři prvky - uhlík C, kyslík O a vodík H - tvoří 98% celkové hmotnosti živých organismů. To přináší určitou ekonomickou efektivitu v živé přírodě: s téměř neomezenou strukturální rozmanitostí sloučenin uhlíku, malý počet chemických vazeb může významně snížit počet enzymů nezbytných pro štěpení a syntézu organických látek. Strukturní charakteristiky atomu uhlíku jsou základem různých typů izomerie organických sloučenin (schopnost opticky izomerizovat byla rozhodující pro biochemický vývoj aminokyselin, sacharidů a některých alkaloidů).
Podle obecně uznávané hypotézy A. I. Oparina byly první organické sloučeniny na Zemi abiogenního původu. Zdrojem uhlíku byly metan (CH4) a kyanovodík (HCN) obsažené v primární atmosféře Země. S výstupem života je jediným zdrojem anorganického uhlíku, díky kterému se tvoří veškerá organická hmota biosféry, oxid uhličitý (CO2) v atmosféře a také rozpuštěný v přírodních vodách ve formě HCO-3. Nejsilnějším mechanismem asimilace (asimilace) uhlíku (ve formě CO2) - fotosyntézy - se provádí všude zelené rostliny (asi 100 miliard tun CO2 se každoročně asimiluje). Na Zemi existuje evolučně starší způsob asimilace CO2 chemosyntézou; V tomto případě chemosyntetické mikroorganismy nepoužívají sálavou energii Slunce, ale oxidační energii anorganických sloučenin. Většina zvířat spotřebovává uhlík z potravin ve formě připravených organických sloučenin. V závislosti na způsobu asimilace organických sloučenin je obvyklé rozlišit autotrofní organismy a heterotrofní organismy. Použití bílkovin a dalších živin mikroorganismů pro biosyntézu, které využívají ropné uhlovodíky jako jediný zdroj uhlíku, je jedním z důležitých moderních vědeckých a technických problémů.
Vedle hlavní funkce - zdroj uhlíku - oxid uhličitý CO2, rozpuštěný v přírodních vodách a biologických tekutinách, se podílí na udržení kyselosti prostředí, které je optimální pro životně důležité procesy. Ve složení CaCO3 vytváří uhlík vnější kostru mnoha bezobratlých (například skořápky měkkýšů) a také se vyskytuje u korálů, ptáků z vaječných skořápků atd. Sloučeniny uhlíku, jako HCN, CO, CCI4, které převládaly v primární atmosféře Země , v procesu biologické evoluce, se změnil na silné antimetabolity metabolismu.
Cyklus uhlíku. Uhlík je hlavní živina; Hraje důležitou roli při tvorbě živé hmoty biosféry. Oxid uhličitý z atmosféry v procesu fotosyntézy prováděný zelenými rostlinami se asimiluje a proměňuje v různorodé a početné organické sloučeniny rostlin. Rostlinné organismy, zvláště nižší mikroorganismy, mořský fytoplankton, způsobené výjimečnou reprodukční rychlostí, produkují asi 1,5 · 10 č. Tun uhlíku ve formě organické hmoty za rok, což odpovídá
5,86 · 10,0 J (1,4 · 10 »Ccal) energie. Rostliny jsou částečně konzumovány zvířaty (s tvorbou více či méně složitých potravinových řetězců). Nakonec se organická hmota v důsledku dýchání organizmů, rozkladu jejich mrtvol, fermentace, rozpadu a procesů spalování změní na oxid uhličitý nebo se uloží ve formě sapropelu, humusu, rašeliny, což zase vyvolává řadu dalších kavustobiolitů - černého uhlí, olej, hořlavé plyny.

Cyklus uhlíku.
V procesech rozkladu organických látek a jejich mineralizaci hrají bakterie obrovskou roli (například hnilobná), stejně jako mnoho hub (např. Plísňové houby).
Velmi malá část jeho celé hmotnosti se účastní cyklu aktivního uhlíku. Obrovské množství kyseliny uhličité konzervované ve formě fosilních vápence a dalších skal. Na druhé straně dochází k pohybující se rovnováze mezi oxidem uhličitým v atmosféře a oceánskou vodou.
Tabulka: Obsah uhlíku na povrchu Země a v zemské kůře (16 km síly)
In tIn g na 1 vizI povrchu Země
Zvířata 5 · 109 0,0015
Rostliny 5 · 10№№ 0,1
Atmosféra 6,4 · 10 · 0,125
Ocean 3.8 · 10 · 7.5
Masivní krystalický
horniny: bazalty a další 1.7. 1014 33.0
hlavní plemeno
Granity, granodiority 2,9 · 1015 567
Uhlí, ropa a další
caustobioliths 6.4 · 1015 663
Křišťálové břidlice 1 · 1016 2000
Uhličitany 1,3 · 1016 2500
Celkem 3,2 · 1016 5770
Mnoho vodních organismů absorbuje uhličitan vápenatý, vytváří kostry a pak tvoří vrstvy vápence. Atmosféra byla vytěžena a zakopána desítkami krát více oxidu uhličitého, než je tomu v současné době. Atmosféra je doplňována oxidem uhličitým v důsledku procesů rozkladu organických látek, uhličitanů atd. A také stále častěji v důsledku průmyslové aktivity člověka. Zvláště silným zdrojem jsou sopky, jejichž plyny se skládají převážně z oxidu uhličitého a vodní páry. Část oxidu uhličitého a vody vybuchla sopky se zrodila z sedimentárních hornin, zejména vápenců, když magma přichází do kontaktu s nimi a jejich asimilace pomocí magmatu. V procesu cirkulace uhlíku je při biogenní tvorbě organické hmoty (uhlí, olej, tkáň, organismy apod.) Opakovaně frakcionován izotopovým složením (č. IC - č. C), zejména v magmatickém procesu (tvorba CO2, diamantů, karbonátů).
Použití uhlíku. Uhlík je široce používán ve formě jednoduchých látek. Drahé diamant je předmětem šperků; Neprůhledný diamant je cenný abrazivní materiál, stejně jako materiál pro výrobu řezáků a jiných nástrojů. Dřevěné uhlí a jiné amorfní formy uhlíku se používají pro bělení, čištění, adsorpci plynu v oblastech technologie, kde jsou vyžadovány adsorbenty s rozvinutým povrchem. Grafit používané k výrobě tavicích kelímků, obkladových desek, elektrod, tuhých maziv; v raketové technologii; jako neutronový moderátor v jaderných reaktorech; složková kompozice pro výrobu prutů pro arandas; pro diamanty; plnící plasty. Uhlí koksu používané v železné metalurgii jako palivo a redukční činidlo ve vysokých pecích a kupolových pecích. Ropný a elektrodový koks se používá k výrobě uhlí a grafitizovaných elektrod, méně často jako palivo. Saze (saze) se používá jako plnivo při výrobě pryže a plastů; pigment v průmyslu barvy; pro výrobu elektrod, atd. Karbidy, sloučeniny uhlíku s kovy, stejně jako s bórem a křemíkem (například Al4C3, SiC, B4C) se vyznačují vysokou tvrdostí a používají se pro výrobu brusných a řezných nástrojů. Uhlík používané k výrobě kovů z jejich oxidů. Uhlík je součástí oceli a slitin v elementárním stavu a ve formě karbidů. Nasycení povrchu ocelových odlitků uhlíkem při vysoké teplotě (cementace) výrazně zvyšuje tvrdost povrchu a odolnost proti opotřebení.

Diamant v špercích,
grafit v tužkách.
Odkazy:1) Encyklopedie velké školy, svazek 2, ed. Olma-press
2) Internet: www.encycl.yandex, www.krugosvet, wwwrmika.
Po dvou desetiletích za sebou se uhlí nachází ve stínu ropného boomu. Hory uhlí, které se neprodávaly, rostly do oblohy. Mnozí miny se zastavily, stovky tisíc horníků ztratily svou práci. Apalačská oblast Spojených států, jakmile se rozvíjela uhelná nádrž, se stala jednou z nejvíce ponurých oblastí chudoby ...
Struktura atomu vodíku v periodickém systému. Stupeň oxidace. Prevalence v přírodě. Vodík jako jednoduchá látka, jejíž molekuly se skládají ze dvou atomů spojených dohromady kovalentní nepolární vazbou. Fyzikální a chemické vlastnosti.
Diamond Slovo "diamant" okamžitě připomíná tajemné příběhy o tajemstvích. Někdy lidé, kteří lovili diamanty, netušili, že jejich vášeň je krystalický uhlík - právě uhlík, který tvoří saze, saze a uhlí. .V ...
Informace o uhlíku, datuje se od starověku a jeho distribuce v přírodě. Přítomnost uhlíku v kůře. Fyzikální a chemické vlastnosti uhlíku. Výroba a využití uhlíku a jeho sloučenin. Adsorpční kapacita aktivního uhlí.
Chemické vlastnosti jednoduchých látek. Obecné informace o uhlíku a křemíku. Chemické sloučeniny uhlíku, jeho kyslík a deriváty obsahující dusík. Karbidy, rozpustné a nerozpustné ve vodě a zředěných kyselinách. Oxygenované sloučeniny křemíku.
Uhlík (C) - typické nekovové; v periodickém systému je ve 2. čtvrtém období skupina IV, hlavní podskupina. Sekvenční číslo 6, Ar = 12,011 amu, jaderný náboj +6.Fyzikální vlastnosti: uhlík tvoří mnoho alotropních modifikací: diamant - jedna z nejtvrdších látek grafit, uhlí, saze.
Uhlíkový atom má 6 elektronů: 1s 2 2s 2 2p 2 . Poslední dva elektrony jsou umístěny na samostatných p-orbitálech a jsou nepárové. V zásadě by tento pár mohl zaujímat jediný orbitální, avšak v tomto případě se výrazně zvyšuje odpuzování elektronů a elektronů. Z tohoto důvodu jedna z nich trvá 2p x, druhá nebo 2p y , nebo 2p z-orbitals.
Rozdíl mezi energií s- a p-subblevels vnější vrstvy je malý, takže atom docela snadno projde do vzrušeného stavu, ve kterém jeden z dvou elektronů z 2s orbitals přechází do volné 2p. Valenční stav nastane s konfigurací 1s 2 2s 1 2p x 1 2p y 1 2p z 1 . Je to stav atomu uhlíku, který je charakteristický pro diamantovou mřížku - tetraedrické prostorové uspořádání hybridních orbitálů, stejné délky a energie vazeb.
Je známo, že je tento jev nazýván sp3 hybridizace a výsledné funkce jsou sp 3 hybrid . Tvorba čtyř sp 3 vazeb poskytuje stabilnější uhlíkový atom než tři rr- a jedno připojení s-s. Kromě sp3 hybridizace na atomu uhlíku jsou také pozorovány sp2 a sp hybridizace. . V prvním případě dochází k vzájemnému překrývání. s- a dvě p-orbitály. Jsou vytvořeny tři ekvivalentní sp 2 - hybridní orbitaly umístěné ve stejné rovině pod úhlem 120 ° vůči sobě. Třetí orbita p je nezměněna a směřuje kolmo k rovině. sp 2.

Při sp hybridizaci se s or p orbitály překrývají. Úhel 180 ° vzniká mezi dvěma ekvivalentními hybridními orbitály, které se tvoří, přičemž dvě p orbity na každém z atomů zůstávají nezměněny.
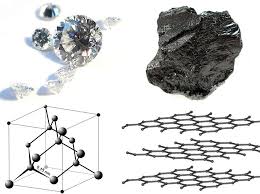
Uhlíková alotropie. Diamant a grafit
V grafitovém krystalu jsou atomy uhlíku umístěny v rovnoběžných rovinách, které zaberou vrcholy pravidelných šestiúhelníků. Každý z atomů uhlíku je spojen s třemi sousedními sp2 hybridními vazbami. Spojení mezi rovnoběžnými rovinami je způsobeno van der Waalsovými silami. Volné p-orbitály každého atomu jsou směrovány kolmo k rovinám kovalentních vazeb. Jejich překryv vysvětluje další p-vazbu mezi atomy uhlíku. Takže od valenční stav, ve kterém jsou atomy uhlíku v látce, závisí na vlastnostech této látky.
Nejcharakterističtější oxidační stavy jsou: +4, +2.
Při nízkých teplotách je uhlík inertní, ale při zahřátí se jeho aktivita zvyšuje.
- s kyslíkem
C 0 + O 2 - t ° = CO 2 oxid uhličitý
s nedostatkem kyslíku - neúplné spalování:
2C 0 + O 2 - t ° = 2C + 20% oxidu uhelnatého
- s fluorem
C + 2F2 = CF4
- s vodní párou
C 0 + H 2 O - 1200 ° C = C + 2 O + H 2 vodní plyn
- s oxidy kovů. Takto tavený kov z rudy.
C 0 + 2CuO - t ° = 2Cu + C + O 2
- s kyselinami - oxidačními činidly:
C0 + 2H2S04 (konc.) = C + 4O2 + 2S02 + 2H20
C 0 + 4HNO 3 (konc.) = C + 4O 2 + 4NO 2 + 2H 2O
- se sírou tvoří sírouhlík:
C + 2S 2 = CS 2.
- tvoří karbidy s některými kovy
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
- s vodíkem - metanem (stejně jako s obrovským množstvím organických sloučenin)
C0 + 2H2 = CH4
- s křemíkem tvoří karborundum (při 2000 ° C v elektrické peci):
Volný uhlík se nachází ve formě diamantu a grafitu. Ve formě sloučenin se nachází uhlík ve složení minerálů: křída, mramor, vápenec - CaCO 3, dolomit - MgCO 3 * CaCO 3; uhlovodíky - Mg (HCO3) 2 a Ca (HCO3) 2, CO 2 je součástí ovzduší; uhlík je hlavní složkou přírodních organických sloučenin - plyn, olej, uhlí, rašelina, je součástí organické hmoty, bílkovin, tuků, uhlohydrátů a aminokyselin tvořících živé organismy.

Ani C 4+ ionty ani C 4 nejsou vytvořeny za běžných chemických procesů: v uhlíkových sloučeninách existují kovalentní vazby různé polarity.
Oxid uhelnatý; bezbarvá, bez zápachu, slabě rozpustná ve vodě, rozpustná v organických rozpouštědlech, jedovatá, t ° kip = -192 ° C; t pl. = -205 ° C.
Zítra
1) v průmyslu (u plynových generátorů):
C + O2 = C02
2) V laboratoři - tepelným rozkladem kyseliny mravenčí nebo kyseliny šťavelové v přítomnosti H2SO4 (konc.):
HCOOH = H20 + CO
H 2 C 2 O 4 = CO + C02 + H 2 O
Chemické vlastnosti
Za normálních podmínek je CO inertní; při zahřátí - redukční činidlo; neformujícího oxidu.
1) s kyslíkem
2C + 2O + O 2 = 2C + 4O 2
2) s oxidy kovů
C + 2O + CuO = Cu + C + 4O 2
3) s chlórem (ve světle)
CO + Cl 2 - hn = COCl 2 (fosgen)
4) reaguje s alkalickými taveninami (pod tlakem)
CO + NaOH = HCOONa (formiát sodný)
5) tvoří karbonylové skupiny s přechodnými kovy
Ni + 4CO - t ° = Ni (CO) 4
Fe + 5CO-t ° = Fe (CO) 5
Oxid uhličitý, bezbarvý, bez zápachu, rozpustnost ve vodě - 0,9VCO2 se rozpouští v 1V H 2 O (za normálních podmínek); těžší než vzduch; t ° pl. = -78,5 ° C (pevný CO 2 se nazývá "suchý led"); nepodporuje spalování.
Zítra
CaCO 3 - t ° = CaO + C02
CaCO3 + 2HCl = CaCl2 + H20 + C02
NaHC03 + HCl = NaCl + H20 + C02
ChemickévlastnostiCO2
Oxid kyseliny: reaguje s bazickými oxidy a bázemi za vzniku solí kyseliny uhličité
Na20 + CO2 = Na2C03
2NaOH + CO2 = Na2C03 + H20
NaOH + C02 = NaHC03
Při zvýšených teplotách mohou vykazovat oxidační vlastnosti.
C + O 2 + 2Mg - t ° = 2Mg + 2O + C 0
Kvalitativní reakce
Zákal vápna:
Ca (OH) 2 + C02 = CaC03 (bílá sraženina) + H 2 O
Zmizí s prodlouženým přenosem CO 2 přes vápennou vodu, protože nerozpustný uhličitan vápenatý přechází do rozpustného bikarbonátu:
CaCO 3 + H 2 O + C02 = Ca (HCO 3) 2
H 2CO 3 -Kyselina je slabá, existuje pouze ve vodném roztoku:
CO 2 + H 2 O ↔ H 2 CO 3
Dibasic:
H 2 CO 3 ↔ H + + HCO 3 - Kyselinové soli - hydrogenuhličitany, hydrogenuhličitany
HCO 3 - ↔ H + + CO 3 2- střední soli - uhličitany
Všechny vlastnosti kyselin jsou charakteristické.
Uhličitany a hydrogenuhličitany se mohou navzájem přeměňovat:
2NaHCO3 - t ° = Na2C03 + H20 + C02
Na2C03 + H20 + CO2 = 2NaHCO3
Uhličitany kovů (vyjma alkalických kovů) dekarboxylát při zahřívání za vzniku oxidu:
CuCO3 - t ° = CuO + C02
Kvalitativní reakce - "vroucí" působením silné kyseliny:
Na2C03 + 2HCl = 2NaCl + H20 + C02
CO 3 2 + 2H + = H 2O + C02
Karbid vápníku:
CaO + 3C = CaC2 + CO
CaC 2 + 2 H 2 O = Ca (OH) 2 + C 2 H 2.
Acetylen se uvolňuje, když zinek, kadmium, lanthan a karbidy ceri reagují s vodou:
2 LaC 2 + 6 H 2 O = 2La (OH) 3 + 2 C 2 H 2 + H 2.
Be 2 C a Al 4 C 3 se rozkládají vodou za vzniku methanu:
Al 4 C 3 + 12 H 2 O = 4 AI (OH) 3 = 3 CH 4.
Technika využívá karbidy titanu TiC, wolfram W 2 C (tvrdé slitiny), silikon SiC (karborundum - jako brusivo a materiál pro ohřívače).
získaný zahřátím sodíku v atmosféře amoniaku a oxidu uhelnatého:
Na2CO3 + 2NH3 + 3CO = 2NaCN + 2H2O + H2 + 2CO2
Kyselina kyanovodíková HCN - důležitý produkt chemického průmyslu, je široce používán v organické syntéze. Jeho světová produkce dosáhne 200 tisíc tun ročně. Elektronická struktura kyanidového aniontu je podobná oxidu uhelnatému (II), takové částice se nazývají isoelektronické:
C = O: [: C = N:] -
Pro těžbu zlata se používají kyanidy (0,1-0,2% vodný roztok):
2 Au + 4 KCN + H 2 O + 0,5 O 2 = 2 K + 2 KOH.
Při vytváření varu roztoků kyanidů se sírou nebo pevnými látkami rodanidy:
KCN + S = KSCN.
Při zahřívání kyanidů nízko aktivních kovů se získá dikyan: Hg (CN) 2 = Hg + (CN) 2. Roztoky kyanidu jsou oxidovány na kyanáty:
2 KCN + O 2 = 2 KOCN.
Kyselina kyanová existuje ve dvou formách:
HN = C = 0; H-O-C = N:
V roce 1828 získal Friedrich Wöhler (1800-1882) močovinu z kyanátu amonného: NH4 OCN = CO (NH2) 2, když byl vodný roztok odpařen.
Tato událost je obvykle považována za vítězství syntetické chemie nad "vitalistickou teorií".
Existuje kyanový izomer - těkavé kyseliny
H-o-n = c.
Jeho soli (chvějící se rtuť Hg (ONC) 2) se používají v rázových zapalovačkách.
Syntéza močovina (karbamid):
CO 2 + 2 NH 3 = CO (NH 2) 2 + H 2 O. Při 130 ° C a 100 atm.
Močovina je amid kyseliny uhličité a existuje její "dusíkový analog", guanidin.
Nejdůležitějšími anorganickými sloučeninami uhlíku jsou uhličitany (uhličitany). H 2 CO 3 je slabá kyselina (K1 = 1,3 · 10-4; K2 = 5 · 10-11). Podpora karbonátového bufferu bilance oxidu uhličitého v atmosféře. Oceán má obrovskou vyrovnávací kapacitu, protože je otevřeným systémem. Hlavní reakce pufru je rovnováha během disociace kyseliny uhličité:
H 2 CO 3 ↔ H + + HCO 3 -.
Při poklesu kyselosti dochází k další absorpci oxidu uhličitého z atmosféry při tvorbě kyseliny:
CO 2 + H 2 O ↔ H 2 CO 3.
S nárůstem kyselosti se rozpouští karbonátové horniny (skořápky, křídové a vápencové usazeniny v oceánu); kompenzuje ztrátu iontů hydrogenuhličitanu:
H + + CO 3 2 - ↔ HCO 3 -
CaCO 3 (TV) ↔ Ca 2+ + CO 3 2-
Tuhé uhličitany se převedou na rozpustné bikarbonáty. Je to proces chemického rozpouštění přebytečného oxidu uhličitého, který působí proti "skleníkovému efektu" - globálnímu oteplování díky absorpci tepelného záření Země oxidem uhličitým. Asi třetina celkové produkce sódy (uhličitan sodný Na2CO3) se používá při výrobě skla.
DEFINICE
Uhlík - šestý prvek periodické tabulky. Označení - C z latinského "karbonu". Nachází se ve druhém období, skupina IVA. Odkazuje na nekovy. Základní náboj je 6.
Uhlík se nachází v přírodě ve volném stavu i ve formě četných sloučenin. Volný uhlík se nachází ve formě diamantu a grafitu. Kromě fosilního uhlí jsou v hlubinách Země velké nahromadění oleje. V kůře jsou nalezeny velké množství solí kyseliny uhličité, zejména uhličitan vápenatý. Ve vzduchu je vždy oxid uhličitý. Konečně, rostlinné a živočišné organismy jsou složeny z látek, u kterých se podílí uhlík. Tento prvek je tedy jedním z nejběžnějších na Zemi, i když jeho celkový obsah v kůře je pouze asi 0,1% (hmotnost).
Relativní molekulová hmotnost látky (M r) je číslo, které udává, kolikrát hmotnost dané molekuly je větší než 1/12 hmotnost atomu uhlíku a relativní atomová hmotnost prvku (A r) je kolikrát průměrná hmotnost atomů chemického prvku je více než 1/12 hmotnost uhlíku.
Vzhledem k tomu, že uhlík existuje ve volném stavu ve formě monatomických molekul C, jeho atomová a molekulová hmotnost se shodují. Jsou 12.0064.
Ve volném stavu uhlík existuje ve formě diamantu, který krystalizuje v kubickém a hexagonálním (lonsdaleite) systému, a grafit, který patří do šestiúhelníku (obr. 1). Uhlíkové formy, jako je uhlí, koks nebo saze, mají neuspořádanou strukturu. Existují také alotropické modifikace, získané synteticky - to jsou karbonové a polykumulinové - uhlíkové odrůdy zkonstruované z lineárních řetězových polymerů typu -C = C- nebo = C = C =.
Obr. 1. Alotropické modifikace uhlíku.
Také jsou známy alotropické modifikace uhlíku, které mají následující názvy: grafen, fulleren, nanotrubice, nanovlákna, astralen, skleněný uhlík, kolosální nanotrubice; amorfní uhlík, uhlíkové nanotrubice a uhlíkové nanopen.
V přírodě uhlík existuje jako dva stabilní izotopy 12 C (98,98%) a 13 C (1,07%). Jejich hmotnostní čísla jsou 12 a 13, resp. Jádro uhlíkového izotopu 12C obsahuje šest protonů a šest neutronů a izotop 13C obsahuje stejný počet protonů a pět neutronů.
Existuje jeden umělý (radioaktivní) uhlíkový izotop 14 Cc s poločasem rozpadu 5730 let.
Na vnější energetické úrovni atomu uhlíku jsou čtyři elektrony, které jsou valencí:
1s 2s 2 2p 2.
V důsledku chemické interakce může uhlík ztrácet své valenční elektrony, tj. být jejich dárcem a přeměnit se na kladně nabité ionty nebo přijímat elektrony jiného atomu, tj. být jejich akceptor a přeměňovat se na záporně nabité ionty:
C 0-2e → C 2+;
C 0-4e → C 4+;
C 0 + 4e → C 4-.
Ve volném stavu existuje uhlík ve formě monatomických molekul C. Představujeme některé vlastnosti, které charakterizují atom a uhlíkovou molekulu:
Nejznámější slitiny uhlíku na světě jsou ocel a litina. Ocel je slitina železa s uhlíkem, jehož obsah uhlíku nepřesahuje 2%. V litině (také slitině železa s uhlíkem) je obsah uhlíku vyšší - od 2 do 4%.
Příklad 1
| Úkol | Jaký objem oxidu uhelnatého (IV) vynikne (NU) při pražení 500 g vápence s obsahem 0,1 hmotnostního podílu nečistot. |
| Řešení | Napíšeme rovnici reakce hořícího vápence: CaCO3 = CaO + C02-. Najděte hmotu čistého vápence. Za tímto účelem nejprve určete hmotnostní zlomek bez nečistot: čistý (CaCO3) = 1 - w nečistota = 1 - 0,1 = 0,9. m čistý (CaCO3) = m (CaCO3) × w čistý (CaCO 3); m čistý (CaCO3) = 500 × 0,9 = 450 g Vypočítejte množství vápence: n (CaC03) = m čirý (CaC03) / M (CaC03); n (CaC03) = 450/100 = 4,5 mol. Podle reakční rovnice n (CaCO 3): n (CO 2) = 1: 1 to znamená n (CaC03) = n (C02) = 4,5 mol. Potom se objem uvolněného oxidu uhelnatého (IV) rovná: V (C02) = n (C02) x Vm; V (CO 2) = 4,5 × 22,4 = 100,8 l. |
| Odpověď | 100,8 l |
Příklad 2
| Úkol | Kolik bude potřebný roztok obsahující 0,05 hmotnostní frakce nebo 5% chlorovodíku k neutralizaci 11,2 g uhličitanu vápenatého? |
| Řešení | Napsali jsme reakční rovnici pro neutralizaci uhličitanu vápenatého chlorovodíkem: CaCO3 + 2HCl = CaCl2 + H20 + C02-. Najděte množství uhličitanu vápenatého: M (CaC03) = Ar (Ca) + Ar (C) + 3x Ar (O); M (CaC03) = 40 + 12 + 3 x 16 = 52 + 48 = 100 g / mol. n (CaC03) = m (CaC03) / M (CaC03); n (CaC03) = 11,2 / 100 = 0,112 mol. Podle rovnice reakce n (CaCO3): n (HCl) = 1: 2 to znamená n (HCI) = 2 x n (CaC03) = 2 x 0,224 mol. Stanovte hmotnost látky chlorovodíku obsažené v roztoku: M (HCI) = Ar (H) + Ar (Cl) = 1 + 35,5 = 36,5 g / mol. m (HC1) = n (HCI) x M (HCI) = 0,224 x 36,5 = 8,176 g Vypočítat hmotnost roztoku chlorovodíku: m roztok (HCl) = m (HCl) x 100 / hmotn. (HCl); m roztok (HCI) = 8,176 x 100/5 = 163,52 g. |
| Odpověď | 163,52 g |